题目内容
已知:A为含金属离子的淡黄色固体化合物,E、X为空气中常见气体,A、B、C、D含有相同的金属离子,其转化关系如图1(部分产物已略去).

请回答下列问题
(l)这种金属离子的离子结构示意图为 ;
(2)X的电子式 ;
(3)B中所含化学键的类型是 ;常温常压下,7.8g A与足量的水充分反应放出热量a kJ,写出该反应的热化学方程式 .
(4)①C也可转化为B,写出该转化的化学方程式 ;
②B与D反应的离子方程式为 .
(5)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图2(忽略气体的溶解和HCl的挥发).
请回答:a点溶液中所含溶质的化学式为 ,b点溶液中各离子浓度由大到小的关系是 .

请回答下列问题
(l)这种金属离子的离子结构示意图为
(2)X的电子式
(3)B中所含化学键的类型是
(4)①C也可转化为B,写出该转化的化学方程式
②B与D反应的离子方程式为
(5)将一定量的气体X通入2L B的溶液中,向所得溶液中边逐滴加入稀盐酸边振荡至过量,产生的气体与盐酸物质的量的关系如图2(忽略气体的溶解和HCl的挥发).
请回答:a点溶液中所含溶质的化学式为
考点:无机物的推断
专题:推断题
分析:E、X为空气中常见气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,据此解答.
解答:
解:E、X为空气中常见气体,A为含金属离子的淡黄色固体化合物,能与水反应生成E与B,应是过氧化钠与水反应生成氢氧化钠与氧气,则A为Na2O2,E为O2,B为NaOH,B与X可以连续反应,可推知X为CO2,C为Na2CO3,D为NaHCO3,
(l)A中金属离子为Na+,离子结构示意图为: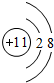 ,故答案为:
,故答案为: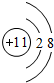 ;
;
(2)X为CO2,其电子式为: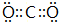 ,故答案为:
,故答案为: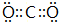 ;
;
(3)B为NaOH,含有离子键、共价键;常温常压下,7.8g Na2O2与足量的水充分反应放出热量a kJ,2mol Na2O2完全反应方程式的热量=a kJ×
=20a kJ,反应热化学方程式为:2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol,
故答案为:离子键、共价键;2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol;
(4)①碳酸钠也可转化为氢氧化钠,该转化的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
②氢氧化钠与碳酸氢钠反应生成碳酸钠与水,反应离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(5)根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比=3:2,所以溶液中还存在NaOH,说明原溶液中为NaOH、Na2CO3,结合方程式可知,溶液中n(NaOH):n(Na2CO3)=1:2,故a点是氢氧化钠前后与盐酸反应碳酸钠未反应,a点时溶液中的溶质是Na2CO3和NaCl,
b点时,碳酸钠恰好转化为碳酸氢钠,b点溶液中的溶质是NaHCO3和NaCl,且n(NaHCO3):n(NaCl)=2:3,钠离子和氯离子不水解,根据元素守恒知c(Na+)>c(Cl-)>c(HCO3-),NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),
故答案为:Na2CO3和NaCl;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(l)A中金属离子为Na+,离子结构示意图为:
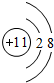 ,故答案为:
,故答案为: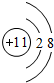 ;
;(2)X为CO2,其电子式为:
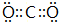 ,故答案为:
,故答案为: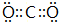 ;
;(3)B为NaOH,含有离子键、共价键;常温常压下,7.8g Na2O2与足量的水充分反应放出热量a kJ,2mol Na2O2完全反应方程式的热量=a kJ×
| 2mol×78g/mol |
| 7.8g |
故答案为:离子键、共价键;2Na2O2(s)+2H2O(l)=4NaOH(aq)+O2(g)△H=-20a kJ/mol;
(4)①碳酸钠也可转化为氢氧化钠,该转化的化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
②氢氧化钠与碳酸氢钠反应生成碳酸钠与水,反应离子方程式为:HCO3-+OH-=CO32-+H2O,
故答案为:HCO3-+OH-=CO32-+H2O;
(5)根据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上产生气体之前消耗盐酸与产生二氧化碳消耗盐酸体积之比=3:2,所以溶液中还存在NaOH,说明原溶液中为NaOH、Na2CO3,结合方程式可知,溶液中n(NaOH):n(Na2CO3)=1:2,故a点是氢氧化钠前后与盐酸反应碳酸钠未反应,a点时溶液中的溶质是Na2CO3和NaCl,
b点时,碳酸钠恰好转化为碳酸氢钠,b点溶液中的溶质是NaHCO3和NaCl,且n(NaHCO3):n(NaCl)=2:3,钠离子和氯离子不水解,根据元素守恒知c(Na+)>c(Cl-)>c(HCO3-),NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),
故答案为:Na2CO3和NaCl;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
点评:本题考查了无机物推断,涉及核外电子排布、电子式、热化学方程式、离子浓度大小比较等知识点,(5)为易错点,清楚发生的反应判断原溶液中溶质及物质的量关系是关键,题目难度中等.

练习册系列答案
 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案
相关题目
下列各组物质按酸、碱、盐分类顺序排列,正确的是( )
| A、硫酸,纯碱(Na2CO3),石灰石 |
| B、醋酸,烧碱(Na OH),硫酸铜 |
| C、硝酸,熟石灰,苛性钾(KOH) |
| D、醋酸,小苏打(NaHCO3),熟石灰(Ca(OH)2) |
在水中存在H2O?H++OH-平衡,加入下列哪种物质或进行哪项操作,不会使平衡发生移动( )
| A、加入NaOH固体 |
| B、加入NaCl固体 |
| C、加入CH3COOH固体 |
| D、升温 |
将一定量的锌与100mL 18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体(标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是( )
| A、气体A为二氧化硫和氢气的混合物 |
| B、气体A中二氧化硫和氢气的体积比为4:1 |
| C、反应中共消耗锌95.5g |
| D、反应中共转移电子1.5mol |
对于同一周期从左到右的主族元素,下列说法中正确的是( )
| A、原子半径逐渐减小 |
| B、元素的金属性逐渐增强 |
| C、最高正化合价逐渐增大 |
| D、单质的熔沸点逐渐降低 |



 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.