题目内容
将一定量的锌与100mL 18.5mol/L浓硫酸充分反应,锌完全溶解,同时生成16.8L气体(标准状况),将反应后的溶液稀释到1L,测得溶液的c(H+)=1mol/L,则下列叙述中错误的是( )
| A、气体A为二氧化硫和氢气的混合物 |
| B、气体A中二氧化硫和氢气的体积比为4:1 |
| C、反应中共消耗锌95.5g |
| D、反应中共转移电子1.5mol |
考点:化学方程式的有关计算,浓硫酸的性质
专题:计算题
分析:气体的物质的量=
=0.75mol,反应前n(H2SO4)=18.5mol×0.1L=1.85mol,n(H+)=2n(H2SO4)=3.7mol,反应后n(H+)=1mol/L×1L=1mol,稀硫酸的物质的量=0.5mol/L×1L=0.5mol,根据原子守恒、转移电子守恒进行计算.
| 16.8L |
| 22.4L/mol |
解答:
解:气体的物质的量=
=0.75mol,反应前n(H2SO4)=18.5mol×0.1L=1.85mol,n(H+)=2n(H2SO4)=3.7mol,反应后n(H+)=1mol/L×1L=1mol,稀硫酸的物质的量=0.5mol/L×1L=0.5mol,浓硫酸和锌反应生成二氧化硫、稀硫酸和锌反应生成氢气,当浓硫酸浓度达到一定程度后,溶液变为稀硫酸,二者反应生成氢气,
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.5mol×1L=1.35mol,
令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
根据气体的物质的量、硫酸的物质的量列方程组
解得
,
所以二氧化硫的物质的量是0.6mol、氢气的物质的量是0.15mol,
A.通过以上分析知,生成气体为二氧化硫和氢气的混合物,故A正确;
B.二氧化硫和氢气的体积之比等于其物质的量之比=0.6mol:0.15mol=4:1,故B正确;
C.消耗锌的质量=65g/mol×0.75mol=48.75g,故C错误;
D.根据气体和转移电子之间的关系式计算转移电子的物质的量,所以转移电子的物质的量=0.6mol×2+0.15mol×2=1.5mol,故D正确;
故选C.
| 16.8L |
| 22.4L/mol |
参加反应的n(H2SO4)=0.1L×18.5mol/L-0.5mol×1L=1.35mol,
令混合气体中SO2、H2的物质的量分别为xmol、ymol,则:
Zn+2H2SO4(浓)=ZnSO4+SO2↑+H2O
x 2x x
Zn+H2SO4(稀)=ZnSO4+H2↑
y y y
根据气体的物质的量、硫酸的物质的量列方程组
|
|
所以二氧化硫的物质的量是0.6mol、氢气的物质的量是0.15mol,
A.通过以上分析知,生成气体为二氧化硫和氢气的混合物,故A正确;
B.二氧化硫和氢气的体积之比等于其物质的量之比=0.6mol:0.15mol=4:1,故B正确;
C.消耗锌的质量=65g/mol×0.75mol=48.75g,故C错误;
D.根据气体和转移电子之间的关系式计算转移电子的物质的量,所以转移电子的物质的量=0.6mol×2+0.15mol×2=1.5mol,故D正确;
故选C.
点评:本题考查了根据方程式的计算,根据方程式中金属、酸、气体之间的关系式列方程式进行计算,注意结合守恒思想分析解答,题目难度中等.

练习册系列答案
相关题目
下列叙述中正确的是( )
| A、将稀氨水逐滴加入硫酸当溶液的pH=7时,c(SO42-)>c(NH4+) | ||
| B、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1>10c2 | ||
| C、0.1mol/L的醋酸溶液加水稀释后,溶液中所有离子浓度都减小 | ||
D、向0.1mol?L-1的氨水中加入少量硫酸铵固体,则溶液中
|
铊是超导材料的组成元素之一,铊在元素周期表中位于第六周期,与铝是同主族元素,元素符号是Tl.以下对铊的单质及其化合物的性质推断中,不正确的是( )
| A、铊是易导电的银白色金属 |
| B、铊能生成+3价的离子 |
| C、Tl3+的氧化能力比Al3+强 |
| D、氢氧化铊的碱性比氢氧化铝强 |
下列事实与浓硫酸具有强氧化性有关的是( )
①常温时用铁制容器运输浓硫酸
②硫酸工业生产中,用浓硫酸吸收SO3
③浓硫酸使蔗糖炭化变黑并有大量气体产生
④浓硫酸用于生产磷肥
⑤浓硫酸不能用来干燥HBr.
①常温时用铁制容器运输浓硫酸
②硫酸工业生产中,用浓硫酸吸收SO3
③浓硫酸使蔗糖炭化变黑并有大量气体产生
④浓硫酸用于生产磷肥
⑤浓硫酸不能用来干燥HBr.
| A、①③④ | B、①②③ |
| C、①③⑤ | D、②③④⑤ |
香叶醛分子的结构简式如图所示.下列叙述正确的是( )
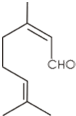

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |
我国镍氢电池居世界先进水平,我军潜艇将装备国产大功率镍氢动力电池.常见镍氢电池的某极是储氢合金LaNi5H6(LaNi5H6中各元素化合价均可视为零价),电池放电时发生的反应通常表示为LaNi5H6+6NiO(OH)═LaNi5+6Ni(OH)2.下列说法正确的是( )
| A、放电时储氢合金作正极 |
| B、放电时负极反应为:LaNi5H6-6e-═LaNi5+6H+ |
| C、充电时阳极周围c(OH-)减小 |
| D、充电时储氢合金作负极 |
下列各组物质均属于电解质的是( )
| A、SO2、Cl2、氨水 |
| B、AgCl、Ba(OH)2、HClO |
| C、NaOH、HCl、NaCl |
| D、酒精、Cu、蔗糖 |

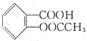 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因: