题目内容
16.和NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,2.8g乙烯含有的共用电子对的数目为0.5NA | |
| B. | 标准状况下,将11.2LCl2通入足量的氢氧化钠溶液中制备漂白液,转移的电子数为NA | |
| C. | VLamol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA | |
| D. | T℃时,1LpH=6的纯水中,含有的OH-的数目为1.0×10-8NA |
分析 A、求出乙烯的物质的量,然后根据1mol乙烯中含6mol共用电子对来分析;
B、求出氯气的物质的量,然后根据氯气和碱的反应为歧化反应来分析;
C、Fe3+为弱碱阳离子,在溶液中会水解;
D、纯水永远显中性.
解答 解:A、2.8g乙烯的物质的量为0.1mol,而1mol乙烯中含6mol共用电子对,故0.1mol乙烯中含0.6NA对共用电子对,故A错误;
B、标况下11.2L氯气的物质的量为0.5mol,而氯气和碱的反应为歧化反应,0.5mol氯气中的0.5mol氯原子变为+1价,另外0.5mol氯原子变为-1价,故0.5mol氯气转移0.5NA个电子,故B错误;
C、Fe3+为弱碱阳离子,在溶液中会水解,故溶液中的铁离子为NA个时,氯离子的个数大于3NA个,故C正确;
D、pH=6的纯水中,氢离子的浓度为10-6mol/L,而纯水永远显中性,故溶液中的氢氧根的浓度也为10-6mol/L,故溶液中的氢氧根的个数为10-6NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学研究的实验报告如表:
该同学的实验目的是研究物质本身的性质对反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持温度相同.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是生成的锰离子有催化作用.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要选择的试剂最合理的是B(选填编号).
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
实验一:甲同学研究的实验报告如表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2mol/L硫酸于试管中; ②分别投入大小、形状相同的Cu、Fe、Mg. | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快. |
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你猜想反应速率明显加快的原因还可能是生成的锰离子有催化作用.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,还需要选择的试剂最合理的是B(选填编号).
A.硫酸钾 B.硫酸锰 C.水 D.氯化锰.
4.下列有关化学用语表示正确的是( )
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}$C | |
| B. | 硫离子的结构示意图: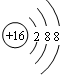 | |
| C. | 氢氧化钠的电子式: | |
| D. | 氮气分子的电子式: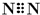 , , |
11.下列离子方程式书写正确的是( )
| A. | 实验室用氯化铝溶液和氨水制氢氧化铝:Al3++3OH-=Al(OH)3↑ | |
| B. | Al与NaOH水溶液反应产生气体:Al+OH-+2H2O=Al(OH)3↓+2H2↑ | |
| C. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
5.有一种有机物C4H4其分子结构如图所示,有关该分子说法正确的是( )
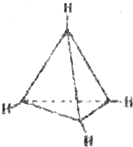

| A. | 该分子是极性分子 | B. | 每个碳原子均为sp2杂化 | ||
| C. | 分子中有极性键和非极性键 | D. | 分子中共有4个碳碳键 |

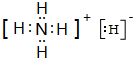 .
. 乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得.
乙炔是一种重要的有机物化工原料,现以它为原料,设计如下转化关系图(部分产物、反应条件已略去),其中A是由等物质的量的乙炔、一氧化碳和水反应而得. 不稳定,会自动转化R-CH2CHO.请回答:
不稳定,会自动转化R-CH2CHO.请回答: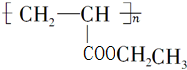 .
.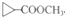 是D的一种同分异构体
是D的一种同分异构体