题目内容
11.下列离子方程式书写正确的是( )| A. | 实验室用氯化铝溶液和氨水制氢氧化铝:Al3++3OH-=Al(OH)3↑ | |
| B. | Al与NaOH水溶液反应产生气体:Al+OH-+2H2O=Al(OH)3↓+2H2↑ | |
| C. | 用盐酸除铜锈[Cu2(OH)2CO3]:Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑ | |
| D. | FeCl3溶液与Cu反应:Fe3++Cu=Fe2++Cu2+ |
分析 A.一水合氨在离子反应中保留化学式;
B.反应生成偏铝酸钠和氢气;
C.反应生成氯化铜、水、二氧化碳;
D.电子、电荷不守恒.
解答 解:A.实验室用氯化铝溶液和氨水制氢氧化铝的离子反应为Al3++3NH3.H2O═Al(0H)3↓+3NH4+,故A错误;
B.Al与NaOH水溶液反应产生气体的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,故B错误;
C.用盐酸除铜锈[Cu2(OH)2CO3]的离子反应为Cu2(OH)2CO3+4H+=2Cu2++3H2O+CO2↑,故C正确;
D.FeCl3溶液与Cu反应的离子反应为2Fe3++Cu=2Fe2++Cu2+,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
2.设NA为阿伏伽德罗常数的值,下列说法不正确的是( )
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
6.抗酸药是一类治疗胃痛的药物,能中和胃里过多的盐酸,缓解胃部不适.下列物质不能作抗酸药的是( )
| A. | 碳酸氢钠 | B. | 氢氧化铝 | C. | 碳酸镁 | D. | 硫酸钡 |
16.和NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,2.8g乙烯含有的共用电子对的数目为0.5NA | |
| B. | 标准状况下,将11.2LCl2通入足量的氢氧化钠溶液中制备漂白液,转移的电子数为NA | |
| C. | VLamol/L的氯化铁溶液中,若Fe3+的数目为NA,则Cl-的数目大于3NA | |
| D. | T℃时,1LpH=6的纯水中,含有的OH-的数目为1.0×10-8NA |
3.下列说法不正确的是( )
| A. | H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强 | |
| B. | I-的还原性比Br-强,由此可推断溴的非金属性比碘强 | |
| C. | H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强 | |
| D. | 已知反应:2NH3+3Cl2═N2+6HCl,由此可推断非金属性氯强于氮 |
20.现有部分短周期元素的性质或原子结构如下表:
(1)元素X在元素周期表中的位置为第二周期第ⅣA族,它的一种核素可测定文物年代,这种核素的符号是146C.
(2)元素Y的原子结构示意图为 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
| 元素编号 | 元素性质或原子结构 |
| T | M层上电子数是K层上电子数的3倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y的原子结构示意图为
 ,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.
,与氢元素形成一种离子YH4+,写出某溶液中含有该微粒的检验方法取适量溶液放入试管中,向试管中加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则可证明溶液中含NH4+.(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示)
1.下列说法不正确的是( )
| A. | 利用贮氢金属和氢气反应生成氢化物的方法,为解决氢气的贮存问题指明了方向 | |
| B. | 科学家发现纳米硒除荧光灯的残汞效果非常好,可见纳米硒的非金属性比一般的硒强 | |
| C. | 在人类对酸碱认识的发展过程中,提出的酸碱质子理论不但适用于水溶液,在非水溶液和无水条件下也适用 | |
| D. | 为了使加酶洗衣粉有良好的洗涤效果,可先用温水溶解洗衣粉 |
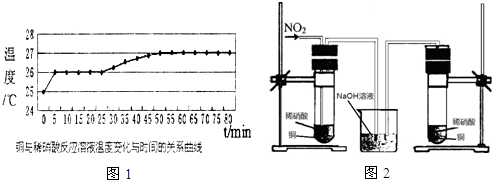
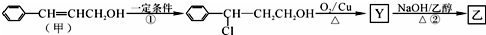
 .1mol乙最多可与5molH2反应.
.1mol乙最多可与5molH2反应.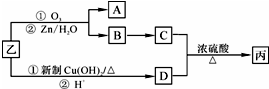
 .
. .
.