题目内容
现有一包由铝粉和氧化铁组成的铝热剂,在高温下充分反应,讲反应后的固体分为两等份,进行一下实验:
(1)向其中一份加过量的氢氧化钠溶液,充分反应,收集到标况下气体11.2L;
(2)向另一份固体中加过量的盐酸,充分反应,收集到标况下气体22.4L;试根据方程式计算出这包铝热剂中各组分的物质的量.
(1)向其中一份加过量的氢氧化钠溶液,充分反应,收集到标况下气体11.2L;
(2)向另一份固体中加过量的盐酸,充分反应,收集到标况下气体22.4L;试根据方程式计算出这包铝热剂中各组分的物质的量.
考点:有关混合物反应的计算,铝的化学性质,铁的氧化物和氢氧化物
专题:计算题,几种重要的金属及其化合物
分析:铝粉和氧化铁组成的铝热剂,在高温下充分反应,得到含有铁和三氧化二铝的混合物,实验(1)的反应原理2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知铝过量,则氧化铁完全反应,由实验(2)生成气体22.4L比实验多11.2L,说明盐酸与铁反应生成氢气11.2L,由此解题.
解答:
解:铝粉和氧化铁组成的铝热剂,在高温下充分反应,得到含有铁和三氧化二铝的混合物,实验(1)的反应原理2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知铝过量,则氧化铁完全反应,
由(1)知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
2mol 67.2L
mol 11.2L
由实验(2)生成气体22.4L比实验多11.2L,说明盐酸与铁反应生成氢气11.2L,
由Fe+2H+=Fe2++H2↑ 2Al+Fe2O3
2Fe+Al2O3
1mol 22.4L 2mol 1mol 2mol
0.5mol 11.2L 0.5mol 0.25mol 0.5mol
所以这包铝热剂中n(Al)=
mol+0.5mol=
mol,n(Fe2O3)=0.25mol,
答:这包铝热剂中铝的物质的量为
mol,氧化铁0.25mol.
由(1)知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
2mol 67.2L
| 1 |
| 3 |
由实验(2)生成气体22.4L比实验多11.2L,说明盐酸与铁反应生成氢气11.2L,
由Fe+2H+=Fe2++H2↑ 2Al+Fe2O3
| ||
1mol 22.4L 2mol 1mol 2mol
0.5mol 11.2L 0.5mol 0.25mol 0.5mol
所以这包铝热剂中n(Al)=
| 1 |
| 3 |
| 5 |
| 6 |
答:这包铝热剂中铝的物质的量为
| 5 |
| 6 |
点评:本题考查铝的性质,铝与酸、碱、金属氧化物之间的反应,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则下列判断中错误的是( )
| A、非金属性:X>Y>Z |
| B、X、Y、Z的最高价氧化物的水化物酸性由弱到强 |
| C、气体氢化物的稳定性,按X、Y、Z顺序递减 |
| D、X、Y、Z的最外层电子数依次减少 |
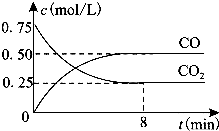 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.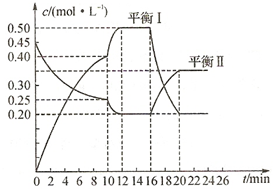 向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应: