题目内容
同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则下列判断中错误的是( )
| A、非金属性:X>Y>Z |
| B、X、Y、Z的最高价氧化物的水化物酸性由弱到强 |
| C、气体氢化物的稳定性,按X、Y、Z顺序递减 |
| D、X、Y、Z的最外层电子数依次减少 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则其原子序数从小到大顺序是Z<Y<X,
A.同一周期元素,元素非金属性随着原子序数增大而增强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其气态氢化物越稳定;
D.同一周期元素,其最外层电子数随着原子序数增大而增大.
A.同一周期元素,元素非金属性随着原子序数增大而增强;
B.元素的非金属性越强,其最高价氧化物的水化物酸性越强;
C.元素的非金属性越强,其气态氢化物越稳定;
D.同一周期元素,其最外层电子数随着原子序数增大而增大.
解答:
解:同周期的三种非金属元素X、Y、Z,它们的原子半径由小到大的顺序是X<Y<Z,则其原子序数从小到大顺序是Z<Y<X,
A.同一周期元素,元素非金属性随着原子序数增大而增强,所以其非金属性强弱顺序是X>Y>Z,故A正确;
B.其非金属性强弱顺序是X>Y>Z,则X、Y、Z的最高价氧化物的水化物酸性由强到弱,故B错误;
C.其非金属性强弱顺序是X>Y>Z,则气体氢化物的稳定性,按X、Y、Z顺序递减,故C正确;
D.同一周期元素,其最外层电子数随着原子序数增大而增大,所以X、Y、Z的最外层电子数依次减少,故D正确;
故选B.
A.同一周期元素,元素非金属性随着原子序数增大而增强,所以其非金属性强弱顺序是X>Y>Z,故A正确;
B.其非金属性强弱顺序是X>Y>Z,则X、Y、Z的最高价氧化物的水化物酸性由强到弱,故B错误;
C.其非金属性强弱顺序是X>Y>Z,则气体氢化物的稳定性,按X、Y、Z顺序递减,故C正确;
D.同一周期元素,其最外层电子数随着原子序数增大而增大,所以X、Y、Z的最外层电子数依次减少,故D正确;
故选B.
点评:本题考查了原子结构和元素周期律,涉及氢化物的稳定性、其最高价氧化物的水化物酸性、非金属性等知识点,正确推断原子序数是解本题关键,再结合元素周期律解答,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
下列判断错误的是( )
| A、酸性:HClO4>H2SO4>H3PO4 |
| B、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| C、沸点:I2>Br2>Cl2>F2 |
| D、沸点:HI>HBr>HCl>HF |
具有下列电子排布式的原子中,原子半径最大的是( )
| A、1s22s22p63s23p2 |
| B、1s22s22p63s2 |
| C、1s22s22p2 |
| D、1s22s22p63s23p4 |
下列5种有机物:①2-甲基丙烷;②乙醇;③丙烷;④丁烷;⑤葡萄糖.按它们的沸点由高到低的顺序排列正确的是( )
| A、①②③④⑤ |
| B、⑤②④①③ |
| C、⑤④②①③ |
| D、③①②⑤④ |
下列反应中,反应物和产物的空间构型不会发生本质变化的是( )
A、CH4
| |||
B、CH2═CH2
| |||
C、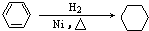 | |||
D、CH4
|
在0.1mol?L-CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述不正确的是( )
| A、加入水时,平衡向正反应方向移动,溶液中n(H+)增大 |
| B、加入少量冰醋酸,平衡向正反应方向移动,溶液中c(H+)增大 |
| C、加入少量0.1mol?L-HCl溶液,平衡向逆反应方向移动,溶液中c(H+)减小 |
| D、加入少量CH3COONa固体,平衡向逆反应方向移动,溶液中c(H+)减小 |
下列说法正确的是( )
| A、H2O和H2O2中的化学键类型完全相同 |
| B、N2的结构式为N-N |
| C、一个H2O分子所含的中子数为8(质量数:H-1,O-16) |
D、NaCl的电子式为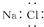 |
下列说法中正确的是( )
| A、醇在Cu或Ag的催化作用下都可以氧化成醛 |
B、有机物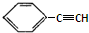 的所有原子一定处于同一平面上 的所有原子一定处于同一平面上 |
| C、醇都可以在浓H2SO4作用下以及170℃时发生消去反应 |
| D、分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |