题目内容
A、B、C、D、E、F六种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,D、E、F为同一周期,A与D,C与F分别为同一主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的元素.又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体.请回答下列问题:
(1)写出F在周期表中的位置 .画出D的离子结构示意图 .
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为 .
(3)C与F形成的常见化合物属于 化合物(填“共价”或“离子”).
(4)画出B单质的结构式 .科学家合成出了B元素形成的B5n+电子式,则n值为 .
(1)写出F在周期表中的位置
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为
(3)C与F形成的常见化合物属于
(4)画出B单质的结构式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:C元素的原子最外层电子数是次外层电子数的三倍,可知C为氧元素;D的原子序数比C大,且D是所在周期原子半径最大的元素,则D为第三周期第ⅠA族元素,即为钠元素;B与C为同一周期,都在第二周期,则A肯定在第一周期,且A与D为同一主族,则A为氢元素;C与F分别为同一主族,D、F为同一周期,则F为硫元素;B位于A和C之间,E位于D和F之间,E肯定是固体,而六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,则可推知B为气体,即B为氮元素,据此可以答题.
解答:
解:C元素的原子最外层电子数是次外层电子数的三倍,可知C为氧元素;D的原子序数比C大,且D是所在周期原子半径最大的元素,则D为第三周期第ⅠA族元素,即为钠元素;B与C为同一周期,都在第二周期,则A肯定在第一周期,且A与D为同一主族,则A为氢元素;C与F分别为同一主族,D、F为同一周期,则F为硫元素;B位于A和C之间,E位于D和F之间,E肯定是固体,而六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,则可推知B为气体,即B为氮元素;
(1)F为硫元素,位于周期表中第三周期第ⅥA族,D为钠元素,钠离子的结构示意图为: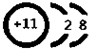 ,故答案为:第三周期第ⅥA族,
,故答案为:第三周期第ⅥA族,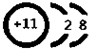 ;
;
(2)A为氢元素,C为氧元素,它们形成化合物可以是H2O和H2O2,其中H2O2能分解产生H2O和O2,所以X为:H2O2Y为:H2O,H2O2的电子式为: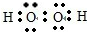 ,故答案为:
,故答案为: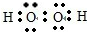 ;
;
(3)C为氧元素,F为硫元素,它们形成的常见化合物为SO2、SO3,它们都是共价化合物,故答案为:共价;
(4)D 为氮元素,B单质为氮气,结构式为N≡N,在N5n+中,由于每个氮原子最外层都有5个电子,要使每个原子能达到八电子稳定结构,可形成如下结构: ,根据这个电子式可以看出这个离子带一个单位的正电荷,所以n为1,故答案为:
,根据这个电子式可以看出这个离子带一个单位的正电荷,所以n为1,故答案为:
N≡N,1
(1)F为硫元素,位于周期表中第三周期第ⅥA族,D为钠元素,钠离子的结构示意图为:
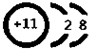 ,故答案为:第三周期第ⅥA族,
,故答案为:第三周期第ⅥA族,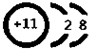 ;
;(2)A为氢元素,C为氧元素,它们形成化合物可以是H2O和H2O2,其中H2O2能分解产生H2O和O2,所以X为:H2O2Y为:H2O,H2O2的电子式为:
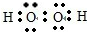 ,故答案为:
,故答案为: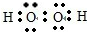 ;
;(3)C为氧元素,F为硫元素,它们形成的常见化合物为SO2、SO3,它们都是共价化合物,故答案为:共价;
(4)D 为氮元素,B单质为氮气,结构式为N≡N,在N5n+中,由于每个氮原子最外层都有5个电子,要使每个原子能达到八电子稳定结构,可形成如下结构:
 ,根据这个电子式可以看出这个离子带一个单位的正电荷,所以n为1,故答案为:
,根据这个电子式可以看出这个离子带一个单位的正电荷,所以n为1,故答案为:N≡N,1
点评:本题的难度在于对元素的推断,要求学生能综合运用原子结构特点及它们在周期表的位置关系来推导元素的种类,对学生综合能力要求较高,另外对于新型分子结构的分析对学生逻辑推理能力要求也较高,所以第(4)问难度也较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
医疗上常用难溶于水的硫酸钡作x射线透视肠胃的内服药剂,俗称“钡餐”.除去硫酸钡中混有的碳酸钡可选用的试剂是( )
| A、.蒸馏水 | B、.食盐水 |
| C、﹒氢氧化钠溶液 | D、.盐酸 |
下列有关实验原理或操作正确的是( )
A、 稀释浓硫酸 |
B、 闻气体气味 |
C、 称量30.46g的NaOH固体 |
D、 点燃酒精灯 |
2molCH4与足量的Cl2发生取代反应,反应完全后,得四种有机物物质的量相等,则消耗的Cl2的物质的量是( )
| A、2mol | B、2.5mol |
| C、4mol | D、5mol |
把0.05mol NaOH晶体分别加入到100mL下列液体中,溶液导电性变化较大是( )
| A、0.5mol/L氯化铵 |
| B、0.5mol/L氨水 |
| C、0.5mol/L H2SO4 |
| D、0.5mol/L盐酸 |
 X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题:
X、Y、W、M、N五种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族元素氢化物的沸点高,但在同周期中却不是最高的.W是同周期元素中离子半径最小的元素.M属s区元素,M原子的最外能层上有两个运动状态不同的电子.N是一种“明星金属”,广泛应用于航天、军事等工业领域.请回答下列问题: