题目内容
12.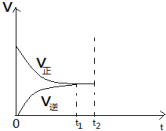 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
分析 在t2时刻及时分离出产物NH3,生成物浓度减小,平衡正向移动,正反应速率大于逆反应速率,至正逆反应速率相等时,达到新的平衡状态,以此来解答.
解答 解:在t2时刻及时分离出产物NH3,生成物浓度减小,平衡正向移动,正反应速率大于逆反应速率,至正逆反应速率相等时,达到新的平衡状态,且t2时正反应速率不变,而逆反应速率减小很多,v-t图为 ,
,
答:平衡正向移动,图象为 .
.
点评 本题考查化学平衡的移动,为高频考点,把握浓度对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意生成物浓度减小的瞬间正反应速率不变,题目难度不大.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: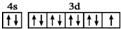 | |
| D. | 基态碳原子的最外层电子排布图: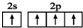 |
3.下列关于键的说法正确的是( )
| A. | 只含共价键的物质一定是共价化合物 | |
| B. | HF、HCl、HBr、HI沸点逐渐增加是因为分子量逐渐增加 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 金属与非金属之间形成的是离子键,非金属之间则形成的是共价键 |
20.某烃的衍生物A,其分子式为C6H12O2,实验表明A和NaOH溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化作用和加热条件下氧化为E,其中D能发生银镜反应而E不能.由此判断A的可能结构有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
7.有一种阳离子与两种酸根离子组成的盐,称为混盐.混盐CaOCl2在酸性条件下,可产生Cl2.则下列有关混盐CaOCl2的判断正确的是( )
| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
1.下列各组物质,不属于同素异形体的是( )
| A. | 金刚石和石墨 | B. | 白磷和红磷 | C. | Na2O和Na2O2 | D. | 氧气和臭氧 |

