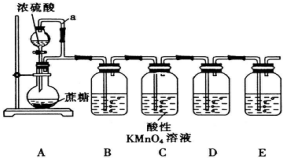
题目内容
2.已知一定量的铁粉与某浓度的硝酸反应,其离子方程式如下:aFe+bH++cNO3-═dFe2++eFe3++fNO+gN2O4+hN2O+iH2O
试确定以下关系
(1)a、d、e的关系:a=d+e
(2)c、f、g、h的关系:c=f+2g+2h
(3)b、c、d、e的关系:b+c=2d+3e
(4)d、e、f、g、h的关系:2d+3e=3f+2g+8h.
分析 (1)a、d、e都是铁元素的系数,根据铁元素质量守恒定律完成;
(2)c、f、g、h表示的都是氮元素的系数,根据氮元素质量守恒定律完成;
(3)b、c、d、e四个系数均表示离子,所以应运用离子电荷守恒解答;
( 4 )d、e、f、g、h四个系数表示氧化产物(代表还原剂)和还原产物(代表氧化剂)的系数,可运用得失电子守恒解答.
解答 解:(1)a、d、e都是铁元素的系数,根据铁元素质量守恒定律:a=d+e,
故答案为:a=d+e;
(2)c、f、g、h表示的都是氮元素的系数,根据氮元素质量守恒定律:c=f+2g+2h,
故答案为:c=f+2g+2h;
(3)b、c、d、e四个系数均表示离子,离子电荷守恒,b+c=2d+3e,
故答案为:b+c=2d+3e;
(4)d、e、f、g、h四个系数表示氧化产物(代表还原剂)和还原产物(代表氧化剂)的系数,得失电子相等,得到电子为:2d+3e,失去电子为:3f+2g+8h,所以2d+3e=3f+2g+8h,
故答案为:2d+3e=3f+2g+8h.
点评 本题考查了方程式的书写,侧重考查书写方程式应遵循的守恒规律,明确方程式遵循的原子个数、电荷数、得失电子守恒是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列实验操作正确的是( )
| A. | 粗盐提纯蒸发时,待水分完全蒸干后停止加热 | |
| B. | 过滤时,漏斗下口尖端紧贴烧杯内壁 | |
| C. | 蒸馏时,冷却水应从冷凝管上口进下口出 | |
| D. | 分液操作时,上层液体应从分液漏斗下口放出 |
14.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 常温下,4g 14CH4含有NA个C-H共价键 | |
| C. | 25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA | |
| D. | 0.1 mol•L-1 Na2CO3溶液中含有0.1NA个CO32- |
2.加热固体试剂时,不能使用的仪器是( )
| A. | 试管 | B. | 集气瓶 | C. | 蒸发皿 | D. | 坩埚 |
3.下列指定微粒的数目相等的是( )
| A. | 等物质的量的H2O与D2O含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的镁和铝分别与足量氯气完全反应时转移的电子数 |
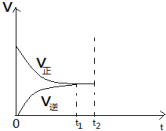 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.