题目内容
2.下列说法正确的是( )| A. | 原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 | |
| B. | Zn2+核外电子排布式为1s22s22p63s23p63d10 | |
| C. | 基态铜原子的外围电子排布图: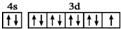 | |
| D. | 基态碳原子的最外层电子排布图: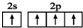 |
分析 A.1s2是He元素属于0族元素,1s22s2是Be元素属于第IIA族元素;
B.锌是30号,失去最外层2个电子得到锌离子,根据构造原理书写;
C.Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,3d、4s能级上电子为其外围电子,然后确定外围电子排布图;
D.基态碳原子的核外电子排布式为1s22s22p2,最外层2s能级上是2个电子.
解答 解:A.1s2是He元素属于0族元素,1s22s2是Be元素属于第IIA族元素,二者性质不同,故A错误;
B.锌原子核外电子排布式为:1s22s22p63s23p63d104s2,失去最外层4s能级2个电子形成Zn2+,最外层已没有电子,故B正确;
C.Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为:3d104s1,图示中3d能级不是10个电子,故C错误;
D.基态碳原子的核外电子排布式为1s22s22p2,最外层2s能级上是2个电子,图示中是2s能级有1个电子跃迁到了2p能级的轨道上,故D错误;
故选B.
点评 本题考查了基态原子或离子的核外电子排布式、电子排布图,注意电子处于全满、半满、全空时最稳定,题目难度不大.

练习册系列答案
相关题目
15.将30mL0.5mol/L NaOH 溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量为( )
| A. | 0.03mol/L | B. | 0.3mol/L | C. | 0.015mol | D. | 0.25 mol |
12.某溶液中含如下离子组中的若干种:K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-,某同学欲探究该溶液的组成,进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,下列说法正确的是( )
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色,下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 步骤Ⅱ中无色气体是NO气体,无CO2气体产生 | |
| C. | 原溶液中肯定含有K+、Fe3+、Fe2+、NO3-、SO42- | |
| D. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 |
19.在标准状况下盛满HCl气体的烧瓶,将烧瓶倒置于水中,使水充满烧瓶,如果氯化氢均溶解在烧瓶中(假设HCl无损失),所得盐酸的物质的量浓度为( )
| A. | 1mol/L | B. | 0.5mol/L | C. | 0.045mol/L | D. | 0.45mol/L |
7. 如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
 如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )
如图所示晶体结构是一种具有优良的压电功能的铁片晶体材料的最小结构单元(晶胞),晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是( )| A. | 8 BaTi8O12 | B. | 8 BaTi4O9 | C. | 6 BaTiO3 | D. | 3 BaTi2O3 |
14.下列说法不符合ⅦA族元素性质特征的是( )
| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |

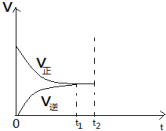 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.