题目内容
4.某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应.其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置.
请回答下列问题:
(1)装置F中发生反应的离子方程式是MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++C12↑+2H2O.
(2)装置A中的烧瓶内固体可选用ACE(选填以下选项的代号).
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
浓氨水与选择固体作用产生氨气的原因是碱石灰、生石灰、氢氧化钠都是碱性物质,且溶于水放出大量的热,使溶液温度升高,有利于NH3•H2O分解.
(3)虚线框内应添加必要的除杂装置,请从右图的备选装置中选择,并将编号填入下列空格.BⅡ、DⅢ、EⅠ.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:8NH3+3C12=6NH4C1+N2;装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体就是氯化铵:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+..
(5)若从装置C中G处逸出的尾气中含有N2和少量C12,处理方法是(用反应的离子方程式表示)Cl2+2OH-=Cl-+ClO-+H2O.
分析 (1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水;
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;
(3)根据杂质的性质选择除杂装置;
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,由此写出反应方程式;鉴定氯化铵时要鉴定氯离子和铵根离子,鉴定氯离子用硝酸酸化的硝酸银,鉴定铵根离子是利用氨气的性质判断;
(5)氯气有毒,不能直接排放到空气,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收尾气.
解答 解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++C12↑+2H2O.
故答案为:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++C12↑+2H2O.
(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、C.生石灰、E烧碱都是碱性物质,碱石灰、生石灰、氢氧化钠溶于水放出大量的热,使溶液温度升高,有利于NH3•H2O分解可以用来制备氨气,D五氧化二磷、B浓硫酸虽然溶于水时放热,但是酸性物质;
故选:A、C、E;碱石灰、生石灰、氢氧化钠都是碱性物质,且溶于水放出大量的热,使溶液温度升高,有利于NH3•H2O分解;
(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故选Ⅱ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和 水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅰ;水蒸气常用浓硫酸除去,故D选Ⅲ.
故答案为:Ⅱ、Ⅲ、Ⅰ.
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气8NH3+3C12=6NH4C1+N2;
氯化铵中含有氯离子和铵根离子,氯离子用硝酸酸化的硝酸银溶液检验;氨气用紫色石蕊试纸检验;检验方法为:将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
故答案为:8NH3+3C12=6NH4C1+N2;将固体在烧杯中溶解,用试管取少量溶液,然后滴加少量硝酸酸化的AgNO3溶液,有白色沉淀产生,证明有C1-;用试管取少量溶液,加入浓烧碱溶液,加热,再将湿润的红色石蕊试纸放在试管口,红色石蕊试纸变蓝证明有NH4+.
(5)氯气有毒,不能直接排放到空气,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收尾气,离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氨气和氯气的制取及性质,熟悉氯气、氨气制备原理及化学性质是解题关键,注意各装置作用,题目难度不大.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 最高价都为+7 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下非金属性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
(1)在标准状况下,CO和CO2的混合气体共33.6L,质量为50g.
①两种气体总的物质的量为1.5mol.
②C与O原子个数比为3:4.
(2)实验室有一瓶失去标签的盐酸和一块镁铜合金,在0℃、1.01×105Pa时,分别向甲、乙、丙三个容器中加入100mL同浓度的盐酸后,再加入不同质量的同种粉末,得到的有关实验数据列于下表,请确定盐酸的浓度和合金的组成:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 8.8 | 17.6 | 22.0 |
| 气体体积/L | 2.24 | 4.48 | 4.48 |
A.实验甲中,盐酸已完全反应
B.实验乙中,金属镁和盐酸恰好完全反应
C.若往实验丙的剩余物中添加盐酸,将继续产生氢气
D.金属铜参加反应并产生氢气
②盐酸的物质的量浓度4mol/L,合金中镁的质量分数27.3%.
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 常温下,4g 14CH4含有NA个C-H共价键 | |
| C. | 25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA | |
| D. | 0.1 mol•L-1 Na2CO3溶液中含有0.1NA个CO32- |
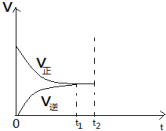 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.