题目内容
7.有一种阳离子与两种酸根离子组成的盐,称为混盐.混盐CaOCl2在酸性条件下,可产生Cl2.则下列有关混盐CaOCl2的判断正确的是( )| A. | 该混盐具有和漂白粉相似的化学性质 | |
| B. | 该混盐的水溶液呈中性 | |
| C. | 该混盐与硫酸反应生成1摩尔氯气时,转移了1摩尔电子 | |
| D. | 该混盐中氯元素的化合价为零 |
分析 由混盐CaOCl2在酸性条件下可以产生Cl2.可知混盐为CaCl2•Ca(ClO)2的形式,在酸性条件下发生:Cl-+ClO-+2H+=Cl2↑+H2O,以此解答该题.
解答 解:A.混盐CaOCl2在酸性条件下可以产生Cl2,溶于水生成HClO,具有漂白性,与具有和漂白粉相似的化学性质,故A正确;
B.混盐为CaCl2•Ca(ClO)2的形式,溶液呈碱性,故B错误;
C.在酸性条件下发生:Cl-+ClO-+2H+=Cl2↑+H2O,由化合价可知产生1molCl2时转移1mole-,故C正确;
D.混盐为CaCl2•Ca(ClO)2的形式,氯元素的化合价分别为+1、-1价,故D错误.
故选AC.
点评 本题考查含氯化合物的性质,为高频考点,注意解答的关键是根据题意判断混盐的组成及发生的氧化还原反应,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
相关题目
19.在标准状况下盛满HCl气体的烧瓶,将烧瓶倒置于水中,使水充满烧瓶,如果氯化氢均溶解在烧瓶中(假设HCl无损失),所得盐酸的物质的量浓度为( )
| A. | 1mol/L | B. | 0.5mol/L | C. | 0.045mol/L | D. | 0.45mol/L |
18.下列实验设计能完成或实验结论合理的( )
| A. | 证明一瓶红棕色气体是溴蒸气还是二氧化氮,可用湿润的碘化钾一淀粉试纸检验,观察试纸颜色的变化 | |
| B. | 铝热剂溶于足量稀盐酸再滴加KSCN溶液,未出现血红色,该铝热剂不含氧化铁 | |
| C. | 测氯水的pH可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较 | |
| D. | 向硅酸钠溶液中,滴入硫酸,可以验证S的非金属性强于Si |
15.下列说法错误的是( )
| A. | 石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 煤干馏和石油分馏本质差别是:干馏是化学变化而分馏是物理变化 | |
| D. | 煤中含有苯和甲苯,可以用先干馏后分馏的方法把它们分离出来 |
2.已知氢化钾(KH)属于离子化合物,KH跟水反应可以放出氢气.下列说法中正确的是( )
| A. | KH的水溶液呈碱性 | B. | KH中氢离子可以被还原为氢气 | ||
| C. | KH是一种强氧化剂 | D. | KH中的氢离子是裸露的质子 |
16.化学计量在化学中占有重要地位,请回答下列问题:
(1)在标准状况下,CO和CO2的混合气体共33.6L,质量为50g.
①两种气体总的物质的量为1.5mol.
②C与O原子个数比为3:4.
(2)实验室有一瓶失去标签的盐酸和一块镁铜合金,在0℃、1.01×105Pa时,分别向甲、乙、丙三个容器中加入100mL同浓度的盐酸后,再加入不同质量的同种粉末,得到的有关实验数据列于下表,请确定盐酸的浓度和合金的组成:
①下列的相关说法正确的是BC(填序号).
A.实验甲中,盐酸已完全反应
B.实验乙中,金属镁和盐酸恰好完全反应
C.若往实验丙的剩余物中添加盐酸,将继续产生氢气
D.金属铜参加反应并产生氢气
②盐酸的物质的量浓度4mol/L,合金中镁的质量分数27.3%.
(1)在标准状况下,CO和CO2的混合气体共33.6L,质量为50g.
①两种气体总的物质的量为1.5mol.
②C与O原子个数比为3:4.
(2)实验室有一瓶失去标签的盐酸和一块镁铜合金,在0℃、1.01×105Pa时,分别向甲、乙、丙三个容器中加入100mL同浓度的盐酸后,再加入不同质量的同种粉末,得到的有关实验数据列于下表,请确定盐酸的浓度和合金的组成:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 8.8 | 17.6 | 22.0 |
| 气体体积/L | 2.24 | 4.48 | 4.48 |
A.实验甲中,盐酸已完全反应
B.实验乙中,金属镁和盐酸恰好完全反应
C.若往实验丙的剩余物中添加盐酸,将继续产生氢气
D.金属铜参加反应并产生氢气
②盐酸的物质的量浓度4mol/L,合金中镁的质量分数27.3%.
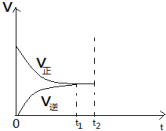 合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.
合成氨的反应中,在第一次平衡(t1时刻)后,在保持容器体积不变的情况下,在t2时刻及时分离出产物NH3,则此时平衡移动的情况是怎样的?请在图中将图补充完整.