��Ŀ����
17��Ԫ�����ڱ���ѧϰ��ѧ����Ҫ���ߣ���������������Ϣ���ɣ��±����������ֶ����ڵ�ԭ�Ӱ뾶����Ҫ���ϼۣ���֪���ԭ�Ӱ뾶Ϊ0.089nm����| Ԫ�ش��� | A | B | C | D | E |
| ԭ�Ӱ뾶/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| ��Ҫ���ϼ� | +2 | +3 | +6��-2 | -1 | -2 |

��2��BԪ�ش���Ԫ�����ڱ��е������ڵڢ�A�壻
��3����Ԫ�����ڱ��н�����ǽ����ķֽ紦�������ҵ��ư뵼����ϵ�Ԫ�أ�
��4����������Ԫ�ص�����������Ӧˮ������������ǿ����HClO4���ѧʽ����
��5��C��E�γɵĻ�����M����ʹ���Ը��������Һ��ɫ��������M�Ļ�ԭ�ԣ�
��6��д��D��ǿ����Һ��Ӧ�����ӷ���ʽCl2+2OH-=Cl-+ClO-+H2O��
���� ԭ�ӵĵ��Ӳ���Խ�࣬��ԭ�Ӱ뾶Խ��ͬһ����Ԫ���У�ԭ�Ӱ뾶����ԭ���������������С�����ԭ�Ӱ뾶Ϊ0.089nm��E��ԭ�Ӱ뾶С���������������-2��Ԫ�ص������=������������-8������Eλ�ڵ�VIA�壬ΪOԪ�أ��⼸��Ԫ�ض��Ƕ�����Ԫ�أ�ԭ�Ӱ뾶��С˳����A��B��C��D���⼸��Ԫ�ص�ԭ�Ӱ뾶��������ԭ�ӣ���Ϊ��������Ԫ�أ��������Ҫ���ϼ�֪��A��MgԪ�ء�B��AlԪ�ء�C��SԪ�ء�D��ClԪ�أ��Դ˽����⣮
��� �⣺ԭ�ӵĵ��Ӳ���Խ�࣬��ԭ�Ӱ뾶Խ��ͬһ����Ԫ���У�ԭ�Ӱ뾶����ԭ���������������С�����ԭ�Ӱ뾶Ϊ0.089nm��E��ԭ�Ӱ뾶С���������������-2��Ԫ�ص������=������������-8������Eλ�ڵ�VIA�壬ΪOԪ�أ��⼸��Ԫ�ض��Ƕ�����Ԫ�أ�ԭ�Ӱ뾶��С˳����A��B��C��D���⼸��Ԫ�ص�ԭ�Ӱ뾶��������ԭ�ӣ���Ϊ��������Ԫ�أ��������Ҫ���ϼ�֪��A��MgԪ�ء�B��AlԪ�ء�C��SԪ�ء�D��ClԪ�أ�
��1��MgԪ��λ�ڵ������ڵ�IA�塢AlԪ��λ�ڵ������ڵ�IIIA�塢Sλ�ڵ������ڵ�VIA�塢ClԪ��λ�ڵ������ڵ�VIIA��OԪ��λ�ڵڶ����ڵ�VIA�壬
�ʴ�Ϊ�� ��
��
��2��Ԫ��ԭ�Ӻ�����Ӳ�������������������������������������������Alԭ�Ӻ�����3�����Ӳ㣬�������3�����ӣ�������Ԫ��λ�ڵ������ڵ�IIIA�壬
�ʴ�Ϊ���������ڢ�A��
��3����Ԫ�����ڱ��н�����ǽ����ķֽ紦�������ҵ��ư뵼����ϵ�Ԫ�أ��ʴ�Ϊ��������ǽ�����
��4������������Ӧˮ����ֱ�ΪMg��OH��2��Al��OH��3��H2SO4��HClO4��Ԫ�صķǽ�����Խǿ��������������ˮ���������Խǿ����OԪ��û�������ϼۣ���ηǽ�����ǿ����ClԪ�أ�����������ǿ������HClO4��
�ʴ�Ϊ��HClO4��
��5��S��O�γɵĻ�����ΪSO2�����������ط���������ԭ��Ӧ������Ϊ��ԭ�ԣ��ʴ�Ϊ����ԭ��
��6������������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ����Ӧ�����ӷ���ʽΪCl2+2OH-=Cl-+ClO-+H2O���ʴ�Ϊ��Cl2+2OH-=Cl-+ClO-+H2O��
���� ���⿼����Ԫ�����ڱ���Ԫ�������ɵ��ۺ�Ӧ�ã�Ϊ��Ƶ���㣬������ѧ���ķ��������Ŀ��飬�е��Ѷȣ�Ԫ���ƶ��ǽ���Ĺؼ�������ʱע�����֪ʶ��������ã�

�ٸı��������ʵ�Ũ�� �ڸı������ѹǿ
�ۼ������ �ܸı�������¶ȣ�
| A�� | ֻ�Т٢� | B�� | ֻ�Тۢ� | C�� | ֻ�Т٢ۢ� | D�� | �٢ڢۢ� |
| A�� | H2SO4��aq��+Ba ��OH��2��aq���TBaSO4��s��+2H2O��l����H=-114.6 kJ•mol-1 | |
| B�� | 2KOH��aq��+H2SO4��aq���TK2SO4��aq��+2H2O��l����H=-57.3 kJ•mol-1 | |
| C�� | C ��s��ʯī��+O2��g���TCO2��g����H=-393.5kJ•mol-1 | |
| D�� | C ��s��ʯī��+$\frac{1}{2}$O2��g���TCO ��g����H=-393.5kJ•mol-1 |
| A�� | �����ɹ��˺�������ʹʳ����� | |
| B�� | �����ܴٽ�ֲ������������Ⱦ���� | |
| C�� | һ����̼������ұ����������ʹ���ж� | |
| D�� | ������̼������������ |
| A�� | NaClO��aq����ͨ�����SO2��ClO-+SO2+H2O=HClO+HSO3- | |
| B�� | FeCl2�ڿ����б�������4Fe2++O2+2H2O=4Fe3++4OH- | |
| C�� | AlCl3��aq����Ͷ������Na��Al3++4Na+2H2O=AlO2-+4Na++2H2�� | |
| D�� | FeBr2��Һ������ʵ�����Cl2��Ӧ��2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| A�� | 1.01��105Pa��20��ʱ48g O3���еķ�����ΪNA | |
| B�� | 1molNa2O2��������������Ϊ2 NA | |
| C�� | ��״���£�33.6L�� �Ҵ���C2H5OH���к��е�̼ԭ����ĿΪ3NA | |
| D�� | ���³�ѹ�£�7.1 g Cl2��������Fe��ַ�Ӧ��ת�Ƶĵ�����ĿΪ0.3 NA |

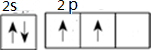
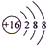 ��A+��C2-��D-�����Ӱ뾶��С����Na+��
��A+��C2-��D-�����Ӱ뾶��С����Na+��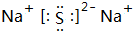 ��
��