题目内容
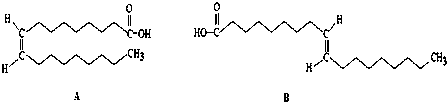
7.已知有以下物质相互转化
试回答:
(1)写出B的化学式FeCl2D的化学式KCl.
(2)写出由E转变成F的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)向G溶液加入A的有关离子反应方程式2Fe3++Fe=3Fe2+.
分析 分析转化关系可知红褐色沉淀F为Fe(OH)3,白色沉淀E为Fe(OH)2,G溶液时氢氧化铁和盐酸反应市场的氯化铁溶液,D溶液中加入硝酸和硝酸银出现白色沉淀H为AgCl,证明D中含氯离子溶液焰色反应透过钴玻璃为紫色,证明溶液中含钾元素,则D为KCl,C溶液为KOH溶液,B为FeCl2溶液,G溶液氯化铁溶液和A为铁发生反应生成氯化亚铁,则A为Fe,A和盐酸反应生成氯化亚铁和氢气,据此分析回答问题.
解答 解:分析转化关系可知红褐色沉淀F为Fe(OH)3,白色沉淀E为Fe(OH)2,G溶液时氢氧化铁和盐酸反应市场的氯化铁溶液,D溶液中加入硝酸和硝酸银出现白色沉淀H为AgCl,证明D中含氯离子溶液焰色反应透过钴玻璃为紫色,证明溶液中含钾元素,则D为KCl,C溶液为KOH溶液,B为FeCl2溶液,G溶液氯化铁溶液和A为铁发生反应生成氯化亚铁,则A为Fe,A和盐酸反应生成氯化亚铁和氢气,
(1)分析可知B为FeCl2,D为KCl,故答案为:FeCl2;KCl;
(2)E转变成F的反应为氢氧化亚铁被氧气氧化生成氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)向G溶液加入A的反应为铁和氯化铁反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查了物质转化关系、物质性质分析判断,主要是铁极其化合物性质的理解应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
4.有6克含杂质的Na2SO3与足量盐酸反应,得气体1.12升(STP),且该气体的平均相对分组质量为60,则杂质可能是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3和NaHCO3 | D. | Na2SO4 |
15.下列叙述正确的是( )
| A. | 2.8 g乙烯与丙烯的混合物中含碳原子的数目为0.2NA | |
| B. | 等物质的量的氢氧根离子(OH-)与羟基(-OH)所含电子数相等 | |
| C. | 常温常压下28 g CO与22.4 L O2所含分子数相等 | |
| D. | 16 g CH4与18 g NH4+所含质子数相等 |
12.下列高分子化合物的单体为一种的是( )
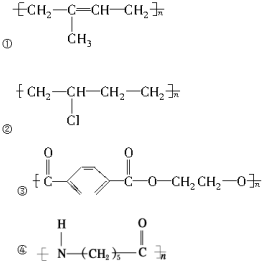

| A. | ①④ | B. | ②③ | C. | ①② | D. | ③④ |
17.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分).

(2)B元素处于元素周期表中第三周期第ⅢA族;
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的还原性.
(6)写出D与强碱溶液反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)B元素处于元素周期表中第三周期第ⅢA族;
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的还原性.
(6)写出D与强碱溶液反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
 .
.