题目内容
2.化学物质通常都有其“功”与“过”,以下对化学物质的评价不符合事实的是( )| A. | 氧气可供人呼吸但会使食物变质 | |
| B. | 化肥能促进植物生长但会污染土壤 | |
| C. | 一氧化碳可用于冶炼金属但会使人中毒 | |
| D. | 二氧化碳能灭火但会造成酸雨 |
分析 A.根据氧气的性质与用途,进行分析判断;
B.根据化肥的用途、对环境的影响分析解答;
C.一氧化碳具有还原性,毒性;
D.依据酸雨成因解答.
解答 解:A.氧气可供人呼吸,但能够氧化食物使其变质,故A正确;
B.化肥能促进植物生长,但施用过多对污染土壤,组成土壤板结等,引起环境污染,故B正确;
C.一氧化碳具有还原性,可用于冶炼金属;但会使人中毒,故C正确;
D.酸雨主要由化石燃料燃烧产生的二氧化硫、氮氧化物等酸性气体,经过复杂的大气化学反应,被雨水吸收溶解而成,与二氧化碳无关,故D错误;
故选:D.
点评 本题考查了常见物质的性质和用途,性质决定用途,熟悉氧气、化肥、一氧化碳的性质,酸雨的成因是解题关键,题目难度不大,注意积累.

练习册系列答案
相关题目
12.下列高分子化合物的单体为一种的是( )
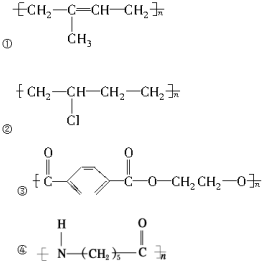

| A. | ①④ | B. | ②③ | C. | ①② | D. | ③④ |
13.科学的假设与猜想是科学探究的先导和价值所在.在下列假设或猜想引导下的探究肯定没有意义的是( )
| A. | 探究SO2和Na2O2可能化合生成Na2SO4 | |
| B. | 探究NO和N2O可能化合生成NO2 | |
| C. | 探究NO2可能被NaOH溶液完全吸收生成NaNO2和NaNO3 | |
| D. | 探究红色酚酞试液通入Cl2褪色,原因是溶液酸碱性改变或被漂白 |
10.已知反应:2CuFeS2+O2═Cu2S+2FeS+SO2对该反应说法正确的是( )
| A. | CuFeS2仅作还原剂,硫元素被氧化 | B. | SO2既是氧化产物又是还原产物 | ||
| C. | FeS既是氧化产物又是还原产物 | D. | 1molO2反应氧化2molCuFeS2 |
17.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
(1)用元素代号标出它们在周期表中对应位置(以下为周期表的一部分).

(2)B元素处于元素周期表中第三周期第ⅢA族;
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的还原性.
(6)写出D与强碱溶液反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |

(2)B元素处于元素周期表中第三周期第ⅢA族;
(3)在元素周期表中金属与非金属的分界处,可以找到制半导体材料的元素;
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)C和E形成的化合物M,能使酸性高锰酸钾溶液褪色,体现了M的还原性.
(6)写出D与强碱溶液反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
7.已知:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.9kJ/mol
某H2与CO的混合气体完全燃烧放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2与CO的物质的量之比是( )
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-282.9kJ/mol
某H2与CO的混合气体完全燃烧放出113.74kJ热量,同时生成3.6g液态水,则原混合气体中H2与CO的物质的量之比是( )
| A. | 1:1 | B. | 1:3 | C. | 1:4 | D. | 2:3 |
14.下列叙述正确是的( )
| A. | 人工固氮的过程一定涉及到氧化还原反应 | |
| B. | 简单的金属阳离子只有氧化性,简单的非金属阴离子只有还原性 | |
| C. | 1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子 | |
| D. | 发生化学反应时,得电子越多的物质,氧化能力越强 |
11.甲、乙两位同学各取相同的KNO3溶液90g,甲将溶液加热蒸发掉20g水后冷却到20℃,析出4g晶体,乙将溶液蒸发掉25g水后也冷却到20℃,析出5.6g晶体,则原KNO3溶液的质量分数为( )
| A. | 32% | B. | 24.2% | C. | 22.2% | D. | 16.7% |
12.NA为阿伏加德罗常数的值.下列说怯错误的是( )
| A. | 18g冰的晶体中含有氢键的数目为2NA | |
| B. | 11.2 L丙烷(标准状况)中含有σ键的数目为5NA | |
| C. | 2.0 L 0.5 mol/L NaAlO2溶液中舍有氧原子的数目为2NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移电子的数目为NA |