题目内容
1.下列对应符号,表述正确的是( )| A. | 一氯甲烷的结构式CH3C1 | B. | 苯的分子式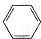 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 丙烷分子的球棍模型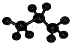 |
分析 A.结构式是用元素符号和短线表示化合物(或单质)分子中原子的排列和结合方式的式子;
B.苯的分子式为C6H6;
C.葡萄糖的分子式为C6H12O6;
D.球棍模型突出的是原子之间的成键的情况及空间结构.
解答 解:A.结构式是用一条短线代替物质中的一对共用电子对所得到的式子,故一氯甲烷的结构式 ,故A错误;
,故A错误;
B.苯的分子式为C6H6,苯的结构简式 ,故B错误;
,故B错误;
C.葡萄糖是多羟基的醛,故其结构简式为CH2OH(CHOH)4CHO,故C错误;
D. 原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确.
原子之间为单键,主链有3个碳原子,氢原子数为8个,符合丙烷的结构,故D正确.
故选D.
点评 本题考查常用化学用语的书写,难度不大,掌握常用化学用语的书写,注意比例模型突出的是原子之间相等大小以及原子的大致连接顺序、空间结构,不能体现原子之间的成键的情况.

练习册系列答案
相关题目
11.下列对有机物结构的叙述中不正确的是( )
| A. | 硝基、羟基、氯原子、苯环、甲基都是官能团 | |
| B. | 邻二甲苯不存在同分异构体,说明苯分子中所有的碳碳键都是完全相同的 | |
| C. | 乙烯、苯分子中所有原子共平面 | |
| D. | CH2Cl2有两种同分异构体 |
12.反应4A (s)+3B (g)?2C (g)+D (g),经2min,B的浓度减少0.6mol/L,对此下列说法不正确的是( )
| A. | 在2 min内的反应速率用B表示为0.3 mol/(L•min) | |
| B. | 在2 min内用A表示反应速率是0.4 mol/(L•min) | |
| C. | 在2 min内用C表示反应速率是0.2 mol/(L•min) | |
| D. | 当V正(B)=3V逆(D)时,反应达到平衡 |
16.矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金--氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,把少量的金浸入溶液中,然后用金属锌作还原剂将金从溶液中置换析出.其反应原理为
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[Zn(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[Zn(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]不溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+1 | |
| C. | 金元素在地壳中能以化合态的形式存在 | |
| D. | 在提炼过程中NaCN作氧化剂 |
13.设NA表示阿伏加德罗常数的数值,下列说法中,不正确的是( )
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 1molAl3+含有核外电子数为10NA | |
| D. | 17gNH3含有的电子数为10NA |
11. 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CO+4OH--2e-=CO32-+2H2O.
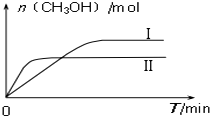
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CH3OH的物质的量随时间的变化图:
①由图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为0.4<n(c)≤1.
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是a b.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个C-H形成
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g).二甲醚可用作直接燃料电池,1mol二甲醚分子经过电化学氧化,可以产生12NA个电子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CO+4OH--2e-=CO32-+2H2O.
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CH3OH的物质的量随时间的变化图:
①由图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是a b.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个C-H形成
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g).二甲醚可用作直接燃料电池,1mol二甲醚分子经过电化学氧化,可以产生12NA个电子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
