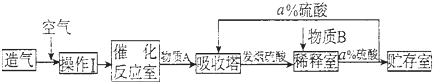
题目内容
6.航天领域中常用N2H4与N2O4作为火箭发射的燃料与助燃剂.N2O4是一种无色气体,易分解:N2O4(g)?2NO2(g)-Q.N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4•H2O.t℃时,将一定量的NO2、N2O4充入一个容积为2L的恒容密闭容器中,浓度随时间变化关系如下表所示:| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol/L | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(Y)/mol/L | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
(2)20min时改变的条件是向容器中加入0.8molNO2;重新达到平衡时,NO2的体积分数B(填字母)
A.增大B.减小C.不变D.无法判断
(3)用电离方程式表示N2H4•H2O显碱性的原因N2H4•H2O?N2H5++OH-(或N2H4+H2O?N2H5++OH-).
(4)相同条件下,1mol N2H4最多能与2mol HCl发生反应.
(5)常温下,若将0.2mol/LN2H4•H2O溶液与0.1mol/L HCl溶液等体积混合,则溶液中N2H${\;}_{5}^{+}$、Cl-、OH-、H+四种离子浓度由大到小的顺序为c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
(提示:相同条件下,N2H4•H2O的电离程度大于N2H5Cl的水解程度.)
分析 (1)前10min内,△c(X)=(0.6-0.2)mol/L=0.4mol/L、△c(Y)=(0.6-0.4)mol/L=0.2mol/L,相同时间内各物质的浓度变化量之比等于其计量数之比,所以X是NO2、Y是N2O4,前10min内用NO2表示的反应速率=$\frac{△c}{△t}$;
该反应中二氧化氮是反应物、四氧化二氮是生成物,其化学平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(2)20min时,二氧化氮浓度增大、四氧化二氮浓度不变,说明改变的条件是改变二氧化氮浓度;
加入二氧化氮相当于增大压强,平衡向气体体积减小的方向移动;
(3)N2H4•H2O电离生成N2H5+和OH-;
(4)氨气分子中的一个H原子被氨基取代生成联胺,则每个联胺分子相当于2个氨气分子,则每mol联胺能和2molHCl反应;
(5)二者混合后溶液中溶质为等物质的量浓度的N2H4•H2O和N2H5Cl,N2H4•H2O的电离程度大于N2H5Cl的水解程度,导致溶液呈碱性,且其电离和水解程度较小,据此判断离子浓度大小.
解答 解:(1)前10min内,△c(X)=(0.6-0.2)mol/L=0.4mol/L、△c(Y)=(0.6-0.4)mol/L=0.2mol/L,相同时间内各物质的浓度变化量之比等于其计量数之比,所以X是NO2、Y是N2O4,前10min内用NO2表示的反应速率=$\frac{△c}{△t}$=$\frac{0.4mol/L}{10min}$=0.04mol/(L.min);
该反应中二氧化氮是反应物、四氧化二氮是生成物,其化学平衡常数K=$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$,
故答案为:0.04;$\frac{{c}^{2}(N{O}_{2})}{c({N}_{2}{O}_{4})}$;
(2)20min时,二氧化氮浓度增大、四氧化二氮浓度不变,说明改变的条件是改变二氧化氮浓度,加入的二氧化氮物质的量=(1.0-0.6)mol/L×2L=0.8mol;
加入二氧化氮相当于增大压强,平衡向气体体积减小的方向移动,导致二氧化氮体积分数减少,
故答案为:向容器中加入0.8mol NO2;B;
(3)N2H4•H2O电离生成N2H5+和OH-,其电离方程式为N2H4•H2O?N2H5++OH- (或N2H4+H2O?N2H5++OH-),故答案为:N2H4•H2O?N2H5++OH- (或N2H4+H2O?N2H5++OH-);
(4)氨气分子中的一个H原子被氨基取代生成联胺,则每个联胺分子相当于2个氨气分子,则每mol联胺能和2molHCl反应,
故答案为:2;
(5)二者混合后溶液中溶质为等物质的量浓度的N2H4•H2O和N2H5Cl,N2H4•H2O的电离程度大于N2H5Cl的水解程度,导致溶液呈碱性,且其电离和水解程度较小,则离子浓度大小顺序是c(N2H5+)>c(Cl-)>c(OH-)>c(H+),
故答案为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
点评 本题考查较综合,涉及离子浓度大小比较、化学平衡计算、化学平衡影响因素、弱电解质的电离等知识点,侧重考查学生分析计算及判断能力,注意题给信息的正确获取及利用,题目难度中等.

| A. | 1.6g臭氧中含有的氧原子数为0.1NA | |
| B. | 18gD2O中含有的质子数为10NA | |
| C. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2L己烷含有的分子数为0.5NA |
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[Zn(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]不溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+1 | |
| C. | 金元素在地壳中能以化合态的形式存在 | |
| D. | 在提炼过程中NaCN作氧化剂 |
| A. | 标准状况下,22.4L氢气和氧气的混合气体,所含分子数为NA | |
| B. | 常温常压下,1mol氦气含有的原子数为2NA | |
| C. | 1molAl3+含有核外电子数为10NA | |
| D. | 17gNH3含有的电子数为10NA |
 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.(1)CO可用于炼铁,已知:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)分离高炉煤气得到的CO与空气可设计成燃料电池,若电解质为碱性.写出该燃料电池的负极反应式CO+4OH--2e-=CO32-+2H2O.
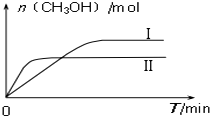
(3)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CH3OH的物质的量随时间的变化图:
①由图判断该反应△H< 0,曲线 I、II对应的平衡常数KI>KII(填“>”或“=”或“<”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
③一定温度下,此反应在恒容密闭容器中进行,能判断该反应达到化学平衡状态的依据是a b.
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个C-H形成
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g).二甲醚可用作直接燃料电池,1mol二甲醚分子经过电化学氧化,可以产生12NA个电子的电量;根据化学反应原理,分析增加压强对制备二甲醚反应的影响该反应分子数减少,压强增加使平衡右移,CH3OCH3产率增加;压强增加使CO和H2浓度增加,反应速率增大.
| … | ① | ② | ③ | |
| … | ④ | ⑤ |
(2)科学家通过对①~⑤元素的化合物进行研究,从而寻找a(选填序号).
a.高效农药 b.催化剂
c.耐高温、耐腐蚀的合金材料 d.半导体材料
(3)研究①~⑤元素的气态氢化物(用化学符号回答):②的气态氢化物的电子式
 .
.(4)④和⑤的元素最高价氧化物对应水化物的酸性较强的物质的化学式H2SO4.
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(2)表中最活泼的金属是K,非金属最强的元素是F;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是Al,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱(用化学方程式表达):Cl2+2NaBr=Br2+2NaCl.
| A. | 农村用酸汤点豆腐 | B. | 有雾的清晨树林里的阳光 | ||
| C. | 澄清石灰水在空气中放置后变浑浊 | D. | 铁盐用于净水 |