题目内容
17.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa固体 | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$减小 |
| B | 0.05molNaHSO4固体 | C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl固体 | 水电离程度增大 |
| D | 50mLH2O | 由水电离出的c(H+)c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
分析 室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,所得溶液的浓度为0.5mol/L.
A、再加入0.05molCH3COONa固体,则c(CH3COO-)的浓度和c(Na+)均增大,但增大幅度不同;
B、加入0.05molNaHSO4固体,能和0.05molCH3COONa反应生成0.05molCH3COOH和0.05molNa2SO4;
C、加入0.05molNH4Cl固体后,和CH3COONa发生双水解,水解程度增大;
D、加入50mL水后,溶液变稀,pH变小,而溶液中所有的氢氧根均来自水的电离,据此分析.
解答 解:室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,所得溶液的浓度为0.5mol/L.
A、再加入0.05molCH3COONa固体,c(Na+)增大为原来的2倍,而由于溶液浓度增大,故CH3COO-的水解程度变小,故c(CH3COO-)大于原来的2倍,则$\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$增大,故A错误;
B、加入0.05molNaHSO4固体,能和0.05molCH3COONa反应生成0.5mol/LCH3COOH和0.5mol/L的Na2SO4的混合溶液,根据物料守恒可知,C(CH3COO-)+c(CH3COOH)=0.5mol/L,而c(Na+)=1mol/L,c(SO42-)=0.5mol/L,故有:C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-),故B正确;
C、加入0.05molNH4Cl固体后,和CH3COONa发生双水解,水解程度增大,则对水的电离的促进会增强,故水的电离程度增大,故C正确;
D、加入50mL水后,溶液变稀,pH变小,即溶液中c(OH-)变小,而溶液中所有的氢氧根均来自水的电离,即水电离出的c(OH-)变小,且水电离出的氢离子浓度和其电离出的氢氧根的浓度相同,故水电离出的c(H+)变小,故由水电离出的c(H+)•c(OH-)减小,故D正确.
故选A.
点评 本题考查了影响盐类水解的因素以及三个守恒的应用,综合性较强,难度适中,是高考热点题型,应加强对应的练习.

 名校课堂系列答案
名校课堂系列答案| A. | 氢氧燃料电池、硅太阳能电池都利用了原电池原理 | |
| B. | 苯是从煤和石油中加工制得的一种重要的化工原料 | |
| C. | 汽车尾气中含有的氮氧化物,是汽油不完全燃烧造成的 | |
| D. | 可用热的饱和Na2CO3溶液除去金属表面的矿物油 |
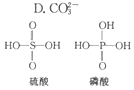 无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )
无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )| A. | 硫酸和磷酸都是强酸 | B. | 硫酸的酸性比磷酸弱 | ||
| C. | 磷酸和硫酸都是弱酸 | D. | 硫酸的酸性比磷酸强 |
| A. | 用菜籽油浸泡花椒制得花椒油的过程主要利用其物理性质 | |
| B. | 卤水点豆腐是Mg2+、Ca2+等使蛋白质胶体发生聚沉的过程 | |
| C. | 热的纯碱溶液可用于除去金属表面的矿物油(如机油、润滑油等) | |
| D. | 亚硝酸钠易致癌,但火腿肠中允许含少量的亚硝酸钠以保持肉质新鲜 |
| A. | Y的最高价氧化物对应水化物的碱性比Z的弱 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | Y3W与YW3中的化学键类型相同 |
| A. | W的简单阴离子半径一定大于Z的简单阳离子半径 | |
| B. | 最简单氢化物的稳定性:X-定强于Y | |
| C. | Y单质分子的电子式-定为  | |
| D. | X、W形成化合物的水溶液必须保存在带玻璃塞的细口瓶中 |
反应①:CO2(g)+H2(g)?CO(g)+H2O(g)△H1=41kJ•mol-1
反应②:CO(g)+2H2(g)?CH3OH(g)△H2=-99kJ•mol-1
反应③:CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H3.
| A. | 反应①为放热反应 | B. | 增大反应①的压强,H2转化率提高 | ||
| C. | 反应②使用催化剂,△H2不变 | D. | △H3=-58 KJ•mol-1 |

| A. | 图①可以表示在绝热容器中放入N2和H2,在催化合成氮的过程中,N2的转化率随时间的变化曲线 | |
| B. | 图②可以表示在T℃的密闭容器中,反应2AgBr(s)?2Ag(s)+Br2(g)达到平衡,此时再开始增大容器的体积,最终容器中仍有AgBr(s)剩余时容器内压强的变化曲线 | |
| C. | 图③可以表示等体积等pH的碳酸钠溶液和醋酸钠溶液加水稀释过程中pH的变化趋势 | |
| D. | 图④可以表示氯化银和溴化银饱和溶液等体积混合后,再向该混合溶液中加入浓AgNO3溶液时,生成沉淀的物质的量随加入AgNO3溶液体积的变化曲线 |
 在容积恒定为2L的密闭容器内通入0.8mol H2和一定量的I2(g),一定温度下发生反应:H2 (g)+I2(g)═2HI(g),反应中各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去.
在容积恒定为2L的密闭容器内通入0.8mol H2和一定量的I2(g),一定温度下发生反应:H2 (g)+I2(g)═2HI(g),反应中各物质的浓度随时间的变化情况如图所示,其中I2(g)的浓度变化曲线前半部分已略去.