题目内容
2.短周期主族元素X、Y、Z、W的原子序数依次减小,其中只有Z为金属元素,X、Y、Z同周期且位于不同奇数族,Z、W同主族,Y、Z的原子序数相差4.下列说法正确的是( )| A. | W的简单阴离子半径一定大于Z的简单阳离子半径 | |
| B. | 最简单氢化物的稳定性:X-定强于Y | |
| C. | Y单质分子的电子式-定为 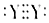 | |
| D. | X、W形成化合物的水溶液必须保存在带玻璃塞的细口瓶中 |
分析 其中只有Z为金属元素,如Z为Na、则W为H元素,Y、Z的原子序数相差4,则Y为P元素,X应为Cl元素,
如Z为Al元素,则W为B元素,Y为Cl元素,X的原子序数大于Cl,不是短周期元素,不符合题意,结合对应单质、化合物的性质以及元素周期律解答该题.
解答 解:由以上分析可知X为Cl元素、Y为P元素,Z为Na元素,W为H元素,
A.H-比Na+少一个电子层,离子半径小于Na+,故A错误;
B.非金属性Cl>P,元素的非金属性越强,对应的氢化物越稳定,故B正确;
C.Y为P元素,对应的单质有红磷、白磷等,白磷为正四面体,红磷更为复杂,电子式不是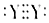 ,故C错误;
,故C错误;
D.盐酸对橡皮塞没有腐蚀性,水溶液不一定用玻璃塞,故D错误.
故选B.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,推断元素是解题关键,注意对元素周期律的理解掌握.

练习册系列答案
相关题目
7.萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是( )

| A. | a和b都属于芳香族化合物 | |
| B. | a和c分子中所有碳原子均处于同一平面上 | |
| C. | a、b和c均能使酸性KMnO4溶液褪色 | |
| D. | b和c均能与新制的Cu(OH)2反应生成红色沉淀 |
13.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 在食品袋中放入盛有硅胶的透气小袋可防止食品因氧化而变质 | |
| B. | 燃烧煤、天然气、石油等排放的大量CO2是导致雾霾产生的原因 | |
| C. | 漂白精可用作消毒剂是由于Ca(ClO)2可转化为HClO | |
| D. | 小苏打能做糕点的膨松剂是由于NaHCO3能与碱反应 |
10.由原子序数依次递增的短周期元素W、X、Y、Z组成的化合物A在一定条件下完全分解,生成甲、乙、丙、丁四种气体,甲、乙分别能使无水硫酸铜、湿润的红色石蕊试纸变蓝,丙能用品红试液检验,丁是大气中与人类生命活动关系最密切的一种气体.下列说法正确的是( )
| A. | 原子半径:W<X<Y<Z | |
| B. | 1mol简单氢化物分别溶于等体积的水中形成体系的pH:Z>Y>X | |
| C. | W与X或Y都能形成既含极性键,又含非极性键的化合物 | |
| D. | 在化合物A的分解反应中丙为氧化产物,丁为还原产物 |
17.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa固体 | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$减小 |
| B | 0.05molNaHSO4固体 | C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl固体 | 水电离程度增大 |
| D | 50mLH2O | 由水电离出的c(H+)c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
7.原子序数依次增大的四种短周期元素X、Y、Z、W,X的最高正化合价与Z的相同,Z原子的最外层电子数是内层电子数的0.4倍,Y元素的周期序数等于族序数,W的最高价氧化物对应的水化物的浓溶液Q是实验室常用的气体干燥剂.下列说法错误的是( )
| A. | 原子半径:Y>Z>W>X | B. | 简单气态氢化物的热稳定性:X>Z | ||
| C. | 野外钢轨焊接中常用到Y的单质 | D. | 加热条件下Q可氧化X、Y、Z的单质 |
2.在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如表:
下列说法正确的是( )
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=akJ/mol.测得有关数据如表:
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,达平衡时CH4 的转化率大于NO2的转化率 |

 ,H2O2的电子式为
,H2O2的电子式为 ,过二硫酸中氧元素的化合价为-1、-2价.
,过二硫酸中氧元素的化合价为-1、-2价.