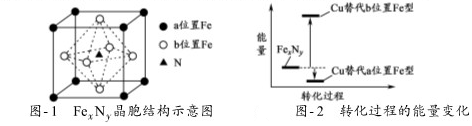
题目内容
8.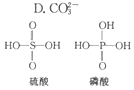 无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )
无机含氧酸的化学式可以用XOn(OH)m来表示(X代表成酸元素,n代表XO基中的氧原子数,m代表OH的数目),若n值越大,m值越小,则该酸的酸性就越强.硫酸、磷酸的结构如图所示,则下列说法正确的是( )| A. | 硫酸和磷酸都是强酸 | B. | 硫酸的酸性比磷酸弱 | ||
| C. | 磷酸和硫酸都是弱酸 | D. | 硫酸的酸性比磷酸强 |
分析 根据题中的信息,含氧酸分子的结构中含非羟基(羟基为-OH)氧原子数越多,酸性越强,以此解答该题.
解答 解:无机含氧酸酸性的化学式可以用XOn(OH)m来表示无机含氧酸(X代表成酸元素,n代表XO基中的氧原子数,m代表OH数),则n值越大,m值越小,该酸的酸性就越强,硫酸、磷酸的结构为 ,硫酸中非羟基氧原子为2比磷酸中多1个,所以硫酸的酸性比磷酸强.
,硫酸中非羟基氧原子为2比磷酸中多1个,所以硫酸的酸性比磷酸强.
故选D.
点评 本题考查物质的结构和性质,为高频考点,侧重考查学生的分析能力,主要把握题给信息,把握物质的结构和性质的关系,难度不大.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
2.短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素.下列说法正确的是( )
| A. | 原子半径:r(X)<r(Y)<r(Z)<r(W) | |
| B. | W的最高价氧化物的水化物是一种弱碱 | |
| C. | Y的单质的氧化性比Z的强 | |
| D. | X、Y、Z 三种元素可以组成共价化合物和离子化合物 |
16.安溪“铁观音”茶属于半发酵茶类,独具“观音韵”,有“七泡有余香之誉”.具有抗衰老、抗动脉硬化、防治糖尿病、减肥健美、防治龋齿、清热降火,敌烟醒酒等功效.为方便饮用,可通过以下方法制取罐装饮料茶:关于上述过程涉及的实验方法、实验操作和物质作用中说法不正确的是( )
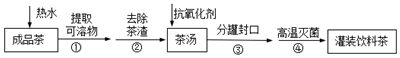

| A. | 步骤②是过滤 | |
| B. | 步骤③是分液,主要仪器是分液漏斗 | |
| C. | 步骤④高温灭菌的原理是使蛋白质细菌变性 | |
| D. | 茶多酚容易被氧化,抗氧化剂可选用维生素C |
3.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法一定正确的是( )
| A. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
13.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 在食品袋中放入盛有硅胶的透气小袋可防止食品因氧化而变质 | |
| B. | 燃烧煤、天然气、石油等排放的大量CO2是导致雾霾产生的原因 | |
| C. | 漂白精可用作消毒剂是由于Ca(ClO)2可转化为HClO | |
| D. | 小苏打能做糕点的膨松剂是由于NaHCO3能与碱反应 |
20.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1,W在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | X的单质可由金属单质置换得到 |
17.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa固体 | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$减小 |
| B | 0.05molNaHSO4固体 | C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl固体 | 水电离程度增大 |
| D | 50mLH2O | 由水电离出的c(H+)c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
6.对于放热反应A2+B2═C2,下列说法正确的是( )
| A. | 产物C2所具有的总能量高于反应物A2和B2所具有的总能量 | |
| B. | 反应物A2和B2所具有的总能量高于产物C2所具有的总能量 | |
| C. | 破坏A2和B2分子内的化学键所吸收的总能量高于形成C2分子内的化学键所放出的总能量 | |
| D. | 破坏A2和B2分子内的化学键所放出的总能量高于形成C2分子内的化学键所吸收的总能量 |
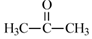 )分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
)分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.