题目内容
15.关于下列图象的描述不正确的是( )
| A. | 图①可以表示在绝热容器中放入N2和H2,在催化合成氮的过程中,N2的转化率随时间的变化曲线 | |
| B. | 图②可以表示在T℃的密闭容器中,反应2AgBr(s)?2Ag(s)+Br2(g)达到平衡,此时再开始增大容器的体积,最终容器中仍有AgBr(s)剩余时容器内压强的变化曲线 | |
| C. | 图③可以表示等体积等pH的碳酸钠溶液和醋酸钠溶液加水稀释过程中pH的变化趋势 | |
| D. | 图④可以表示氯化银和溴化银饱和溶液等体积混合后,再向该混合溶液中加入浓AgNO3溶液时,生成沉淀的物质的量随加入AgNO3溶液体积的变化曲线 |
分析 A.绝热容器中放入N2和H2,随着反应的进行,氮气的转化率逐渐增大;
B.对于反应2AgBr(s)?2Ag(s)+Br2(g),气体只有溴,温度不变,达到平衡时溴的浓度不变;
C.等pH的碳酸钠溶液和醋酸钠溶液,醋酸钠浓度较大;
D.AgCl的溶解度较大,加入硝酸银生成的AgCl的物质的量大.
解答 解:A.表示在绝热容器中放入N2和H2,反应正向移动,随着反应的进行,氮气的转化率逐渐增大,直至达到平衡状态,故A正确;
B.对于反应2AgBr(s)?2Ag(s)+Br2(g),气体只有溴,则K=c(Br2),温度不变,K不变,则达到平衡时溴的浓度不变,故B正确;
C.醋酸比碳酸的酸性强,等pH的碳酸钠溶液和醋酸钠溶液,醋酸钠浓度较大,加入稀释,醋酸钠的pH大于碳酸钠,故C正确;
D.AgCl的溶解度较大,与AgBr等体积混合,加入硝酸银生成的AgCl的物质的量大,图象不符,故D错误.
故选D.
点评 本题考查较为综合,涉及化学平衡移动、盐类的水解以及难溶电解质的溶解平衡,为高频考点,侧重考查学生的分析能力,注意把握图象分析,把握影响平衡移动的因素,难度中等.

练习册系列答案
相关题目
17.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa固体 | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$减小 |
| B | 0.05molNaHSO4固体 | C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl固体 | 水电离程度增大 |
| D | 50mLH2O | 由水电离出的c(H+)c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
6.对于放热反应A2+B2═C2,下列说法正确的是( )
| A. | 产物C2所具有的总能量高于反应物A2和B2所具有的总能量 | |
| B. | 反应物A2和B2所具有的总能量高于产物C2所具有的总能量 | |
| C. | 破坏A2和B2分子内的化学键所吸收的总能量高于形成C2分子内的化学键所放出的总能量 | |
| D. | 破坏A2和B2分子内的化学键所放出的总能量高于形成C2分子内的化学键所吸收的总能量 |
3.一氧化氮与一氧化碳是汽车尾气里的有害物质,他们能缓慢地起反应生成氮气和二氧化碳.对此反应,下列叙不正确的是( )
| A. | 使用催化剂能加快反应速率 | B. | 降低压强能加快反应速率 | ||
| C. | 增大压强能加快反应速率 | D. | 升高温度能加快反应速率 |
10.高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示,下列叙述错误的是( )

| A. | pH=2.2时,溶液中主要含铁形体浓度的大小关系为c(H3FeO4+)>c(HFeO4-) | |
| B. | 为获得尽可能纯净的高铁酸盐,pH应控制pH≥9 | |
| C. | 常温时,NaHFeO4水溶液显碱性 | |
| D. | 向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-═FeO42-+H2O |
7.实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如图1:
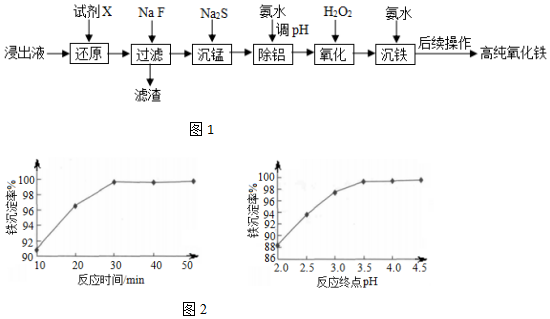
已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
(1)“还原”时,应选择C(填字母).
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有CaF2、MgF2(填化学式).
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10-14.为确保沉锰完全[即溶液中c(Mn2+)<1.0×10-6 mol•L-1],应保持溶液中c(S2-)>4.65×10-8mol•L-1mol•L-1.
(4)“除铝”时,控制溶液pH的范围为5.0~5.8.
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为Cr2O72-+14H++6Fe2+═2Cr3++6Fe3++7H2O.
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是反应时间30min、终点pH=3.5.

已知流程中相关金属离子生成氢氧化物沉淀的pH如表:
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有CaF2、MgF2(填化学式).
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10-14.为确保沉锰完全[即溶液中c(Mn2+)<1.0×10-6 mol•L-1],应保持溶液中c(S2-)>4.65×10-8mol•L-1mol•L-1.
(4)“除铝”时,控制溶液pH的范围为5.0~5.8.
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为Cr2O72-+14H++6Fe2+═2Cr3++6Fe3++7H2O.
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如图2所示,则最佳的工艺条件是反应时间30min、终点pH=3.5.
4.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| B. | 2molNO和1molO2在密闭容器中充分反应,反应后容器中的分子数小于2NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| D. | 1molNa与O2完全反应.生成Na2O和Na2O2的混合物,转移电子总数为NA |
18.若把元素周期表原来的主副族及族号取消,从左到右共有18列,则下列说法中错误的是( )
| A. | 第17列为卤族元素 | |
| B. | 第9列元素中没有非金属元素 | |
| C. | 只有第2列元素原子的最外层有2个电子 | |
| D. | 在整个18列元素中,第3列元素种类最多 |
 ,H2O2的电子式为
,H2O2的电子式为 ,过二硫酸中氧元素的化合价为-1、-2价.
,过二硫酸中氧元素的化合价为-1、-2价.