题目内容
12.W、X、Y、Z是原子序数依次增大的短周期主族元素,W的氢化物常用作制冷剂,W与Y最外层电子数之和与X最外层电子数相等,Z最外层电子数等于最内层电子数.下列说法正确的是( )| A. | Y的最高价氧化物对应水化物的碱性比Z的弱 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | Y3W与YW3中的化学键类型相同 |
分析 W、X、Y、Z是原子序数依次增大的短周期主族元素,W的氢化物常用作制冷剂,W为N元素;Z最外层电子数等于最内层电子数,则Z为第三周期的Mg元素,W与Y最外层电子数之和与X最外层电子数相等,则Y的最外层电子数为1或2,X的最外层电子数为6或7,结合Z为Mg可知,Y为Na,X为O,以此来解答.
解答 解:由上述分析可知,W为N,X为O,Y为Na,Z为Mg,
A.金属性Y>Z,则Y的最高价氧化物对应水化物的碱性比Z的强,故A错误;
B.非金属性X>W,则X的气态氢化物比W的稳定,故B错误;
C.具有相同电子排布的离子中原子序数大的离子半径小,则离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z),故C正确;
D.Y3W只含离子键,YW3中化学键为离子键、非极性共价键,类型不相同,故D错误;
故选C.
点评 本题考查原子结构与元素周期律,为高频考点,把握物质的性质、原子结构来推断元素为解答的关键,侧重分析与应用能力的考查,注意液氨为常用的制冷剂,选项D为解答的难点,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
17.下列有关实验仪器的使用及实验操作正确的是( )
| A. | 加热蒸发皿和烧杯必须垫石棉网 | |
| B. | 除去乙醇中的乙酸,加入NaOH溶液后分液 | |
| C. | 将硫酸铜溶液蒸发浓缩、冷却结晶得到CuSO4•5H2O | |
| D. | 配制1 L 0.1mol•L-1NaCl溶液的实验中,用托盘天平称取5.85g NaCl |
3.已知W、X、Y、Z为短周期元素,原子序数依次增大.W、Z同主族,X、Y、Z同周期,其中只有X为金属元素.下列说法一定正确的是( )
| A. | W的含氧酸的酸性比Z的含氧酸的酸性强 | |
| B. | 原子半径:X>Y>Z>W | |
| C. | W的气态氢化物的稳定性小于Y的气态氢化物的稳定性 | |
| D. | 若W与X原子序数差为5,则形成化合物的化学式为X3W2 |
20.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1,W在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | X的单质可由金属单质置换得到 |
7.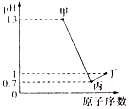 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
 X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )
X、Y、Z、W为四种短周期元素,它们的最高价氧化物对应水化物分别为甲、乙、丙、丁.常温下甲、丙、丁均可与乙反应生成盐和水,Z、W的原子序数及0.1mol/L甲、丙、丁溶液的pH如图所示(已知lg2=0.3).下列说法正确的是( )| A. | 简单阴离子的还原性:Z<W | |
| B. | Y、Z的简单离子都会影响水的电离平衡 | |
| C. | 乙固体中加入甲的溶液或浓氨水,固体都能溶解 | |
| D. | X、Y分别与W形成的化合物皆为离子化合物 |
17.室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa固体 | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$减小 |
| B | 0.05molNaHSO4固体 | C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl固体 | 水电离程度增大 |
| D | 50mLH2O | 由水电离出的c(H+)c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
4.短周期主族元素X、Y、Z、W的原子序数依次增大,X、W同主族;Y、Z同周期;X、Y、Z三种元素形成一种化合物M,25℃时,0.1mol•L-1的M溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1.0×10-12.下列说法正确的是( )
| A. | 简单离子半径:Y<Z<W | |
| B. | X分別与Z、W形成的化合物中,所含化学键类型相同 | |
| C. | X、Y形成的最简单化合物的电子式为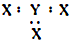 | |
| D. | Z分別与X、W均可形成具有漂白性的化合物 |
9.下列反应中属于放热反应而且是氧化还原反应的是( )
| A. | 铝粉与氧化铁粉末反应 | B. | 强酸与强碱的中和反应 | ||
| C. | 碳酸钙受热分解 | D. | 氧化钙溶于水 |
10.高铁酸盐在水溶液中有四种含铁型体,25℃时,它们的物质的量分数随pH的变化如图所示,下列叙述错误的是( )

| A. | pH=2.2时,溶液中主要含铁形体浓度的大小关系为c(H3FeO4+)>c(HFeO4-) | |
| B. | 为获得尽可能纯净的高铁酸盐,pH应控制pH≥9 | |
| C. | 常温时,NaHFeO4水溶液显碱性 | |
| D. | 向pH=6的高铁酸盐溶液中加入KOH溶液,发生反应的离子方程式为HFeO4-+OH-═FeO42-+H2O |