题目内容
9.已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL 0.1mol•L-1HA溶液中逐滴加入0.2mol•L-1KOH溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是( )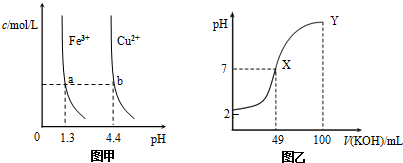
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |
分析 A、根据图象找出可用来比较Fe(OH)3与Cu(OH)2溶度积常数点,可用b、a进行计算;
B、a、b点溶液中Kw只和温度有关,温度不变,Kw不变;
C、根据图示可知,0.1mol•L-1HA溶液的pH=2,说明溶液中 HA在溶液中部分电离;
D、Y点HA与氢氧化钾恰好反应生成KA,A-部分水解,溶液显示碱性.
解答 解:A、由a、b两点对应数据可比较出Ksp[Fe(OH)3]与Ksp[Cu(OH)2]的大小,Ksp[Fe(OH)3]=c(Fe3+)•(OH-)3=c(Fe3+)•(10-12.7)3,Ksp[Cu(OH)2]=c(Cu2+)•(OH-)2=c(Cu2+)•(10-9.6)2,因c(Fe3+)=c(Cu2+),故Ksp[Fe(OH)3]<Ksp[Cu(OH)2],故A正确;
B、由图甲知:a、b点溶液中Kw一样大,故B错误;
C、HA若是强酸,则0.1mol•L-1HA溶液的pH=1,而图象中溶液的pH>2,则HA部分电离,则HA为一元弱酸,故C错误;
D、Y点加入100mL氢氧化钾溶液后,100mL 0.1mol•L-1HA与100mL 0.2mol•L-1KOH溶液反应生成0.05mol•L-1KA和0.05mol•L-1KOH的混合物,氢氧根离子浓度大于0.05mol/L,而A-部分水解,溶液中A-部分水解的浓度小于0.05mol/L,则溶液中离子浓度大小为:c(K+)>c(OH-)>c(A-),故D错误;
故选A.
点评 本题考查了沉淀溶解平衡、溶度积、pH、水的离子积、酸碱混合的定性判断及溶液中离子浓度大小比较知识,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确盐的水解原理及其应用方法,正确分析图象曲线变化为解答关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.向 500mLFeCl3溶液中通入一定量的 H2S气体,恰好完全反应,所得滤液的质量比原来增重1g,则原 FeCl3溶液的物质的量浓度为( )
| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
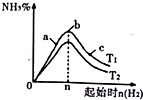
20.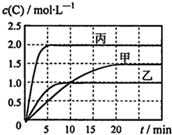 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
下列说法正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
14.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol CO,与原平衡相比,达到新平衡时CO转化率减小,H2的体积分数也减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
18. 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
 已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )
已知:2CrO42-+2H+?Cr2O72-+H2O.25℃时,调节初始浓度为1.0mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如图所示的曲线.下列说法不正确的是( )| A. | 平衡时,pH越小,c(Cr2O72-)越大 | |
| B. | A点CrO42-的平衡转化率为50% | |
| C. | A点CrO42-转化为Cr2O72-反应的平衡常数K=1014 | |
| D. | 平衡时,若溶液中c(Cr2O72-)=c(Cr2O42-),则c(H+)>2.0×10-7 mol•L-1 |
19.下列叙述正确的是( )
| A. | 中和10 mL 0.1mol•L-1 醋酸与中和100 mL 0.01mol•L-1 的醋酸所需同种碱溶液的用量不同 | |
| B. | 两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 | |
| C. | 常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 |