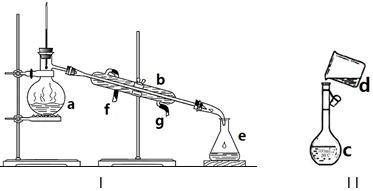
题目内容
6.向 500mLFeCl3溶液中通入一定量的 H2S气体,恰好完全反应,所得滤液的质量比原来增重1g,则原 FeCl3溶液的物质的量浓度为( )| A. | 1 mol•L-1 | B. | 1.5 mol•L-1 | C. | 2 mol•L-1 | D. | 2.5 mol•L-1 |
分析 该反应过程为:2FeCl3+H2S=2FeCl2+S↓+2HCl,△m=2,根据所得滤液的质量比原来增重1g计算氯化铁的物质的量浓度.
解答 解:该反应过程为:2FeCl3+H2S=2FeCl2+S↓+2HCl,△m 设原 FeCl3溶液的物质的量浓度为cmol/L,则有
2 34-32=2
0.5c 1g
所以0.5c=1,解得c=2mol/L,
故选C.
点评 本题考查了物质的量的有关计算,明确反应实质是解本题关键,然后利用差量法进行分析解答即可,难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
17.碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合)下列说法正确的是( )
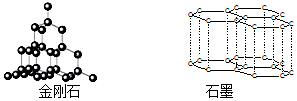
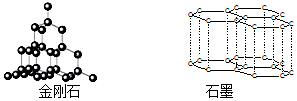
| A. | 根据:C(金刚石,s)+O2(g)═CO2(g)△H=-395.41 kJ•mol-1C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1说明金刚石比石墨稳定,石墨转变为金刚石为放热反应 | |
| B. | 相同质量的金刚石与石墨晶体中,所含共价键数相同 | |
| C. | 估计金刚石与石墨的熔沸点均较高,硬度均较大 | |
| D. | 现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
14.下列防止金属腐蚀的做法不可行的是( )
| A. | 在铁制的炒锅、蒸锅等炊具上镀铜、防止生锈 | |
| B. | 地下钢铁管道连接镁块来防止钢铁锈蚀 | |
| C. | 健身器材刷油漆以防锈 | |
| D. | 洗衣机的滚筒采用不锈钢材料、既耐磨又耐腐蚀 |
1.下列化学反应中,离子方程式表示正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 铁屑在稀H2SO4作用下产生H2Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
18.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 食盐溶于水 | B. | 碳酸氢钠溶于水 | C. | 将HCl通入水中 | D. | 氯化铵受热分解 |
8.向盛有 0.1mol/LAgNO3 溶液的试管中滴加 0.05mol/LNa2S 溶液至沉淀完全,再向上层清液中滴加足量 NaCl,产生的现象及发生的反应是( )
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
9.已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化图.图乙是常温下向100mL 0.1mol•L-1HA溶液中逐滴加入0.2mol•L-1KOH溶液,混合溶液的pH变化图.如图所示与推测的结论相符的是( )
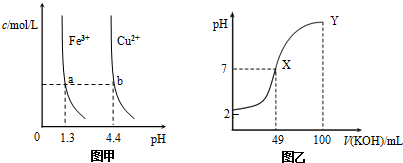

| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |