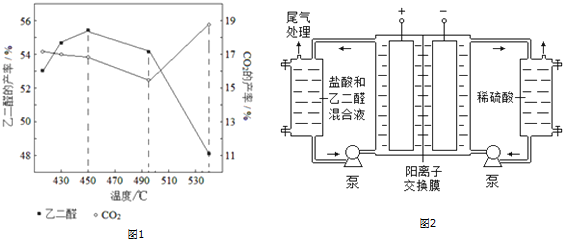
题目内容
20.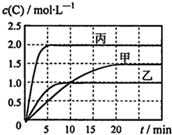 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
分析 图表数据分析可知,甲容器中
A(g)+хB(g)?2C(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 0.75 0.75x 0.75
平衡量(mol/L) 2.25 1-0.75x 0.75
乙容器中
A(g)+хB(g)?2C(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 0.5 0.5x 1
平衡量(mol/L) 2.5 1-0.5x 1
丙容器中
A(g)+хB(g)?2C(g)
起始量(mol/L) 6 2 0
变化量(mol/L) 1 x 2
平衡量(mol/L) 5 1-x 2
乙和丙相比,A的转化率相同都为=$\frac{1}{6}$×100%,丙中压强为乙中2倍,压强增大平衡不移动,故x=1,
A.上述分析可知达平衡时A(g)的浓度大小;
B.x=1,转化率=$\frac{消耗量}{起始量}$×100%;
C.甲乙起始量相同,先拐先平温度高;
D.计算丙状态下的平衡常数,丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),计算此时的浓度商和平衡常数比较判断反应进行的方向.
解答 解:图表数据分析可知,甲容器中
A(g)+хB(g)?2C(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 0.75 0.75x 0.75
平衡量(mol/L) 2.25 1-0.75x 0.75
乙容器中
A(g)+хB(g)?2C(g)
起始量(mol/L) 3 1 0
变化量(mol/L) 0.5 0.5x 1
平衡量(mol/L) 2.5 1-0.5x 1
丙容器中
A(g)+хB(g)?2C(g)
起始量(mol/L) 6 2 0
变化量(mol/L) 1 x 2
平衡量(mol/L) 5 2-x 2
乙和丙相比,A的转化率相同都为=$\frac{1}{6}$×100%,丙中压强为乙中2倍,压强增大平衡不移动,故x=1,
A.上述分析可知达平衡时A(g)的浓度大小,丙>甲>乙,故A错误;
B.x=1,甲中B的转化率=$\frac{消耗量}{起始量}$×100%=;$\frac{0.75}{1}$×100%=75%,故B正确;
C.甲乙起始量相同,先拐先平温度高,则T2>T1,温度越高C的浓度越小,说明升温平衡逆向进行,正反应为放热反应,K(T1)>K(T2),故C错误;
D.计算丙状态下的平衡常数,K=$\frac{{2}^{2}}{5×1}$=0.8,丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),计算此时的浓度商Qc=$\frac{{3}^{2}}{6×2}$=0.75,Qc<K,反应正向进行,故D错误;
故选B.
点评 本题考查化学反应速率计算、影响化学平衡移动的盐酸、化学平衡图象与有关计算,题目难度中等,判断x的值是解题的关键.

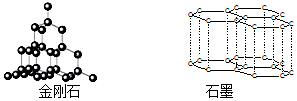
| A. | 根据:C(金刚石,s)+O2(g)═CO2(g)△H=-395.41 kJ•mol-1C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1说明金刚石比石墨稳定,石墨转变为金刚石为放热反应 | |
| B. | 相同质量的金刚石与石墨晶体中,所含共价键数相同 | |
| C. | 估计金刚石与石墨的熔沸点均较高,硬度均较大 | |
| D. | 现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
| A. | 食盐溶于水 | B. | 碳酸氢钠溶于水 | C. | 将HCl通入水中 | D. | 氯化铵受热分解 |
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
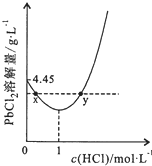 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
 N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用Ⅰ.CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)图1是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况.用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kj/mol、726.83kj/mol、285.2kj/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH).
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
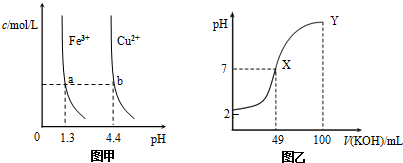
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |