题目内容
17.利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备联氨(N2H4),硝酸等.回答下列问题:(1)联氨可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.已知:
①N2(g)+2O2(g)═N2O4(I)△H1=-19.5kJ/mol
②N2O4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ/mol
写出联氨和N2O4反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol.
(2)某科研小组研究,在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)?2NH3(g)△H=-92.4KH/mol的影响.实验结果如图所示(图中T表示温度,n表示物质的量,NH3%表示NH3的平衡体积分数):
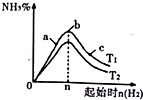
①图象中T2和T1的关系是:T2<T1(填“>”“<”或“无法确定”).
②比较在a、b、c三点所处的平衡状态中,反应物N2转化率最高的是c (填字母).
③T1温度下,若容器容积为1L,在起始体系中加入1mol N2,n=3mol,反应达到平衡时H2的转化率为60%,保持容器的体积、温度不变,再向容器内放入1mol N2、3molH2反应达平衡时,氢气的转化率将增大(填“增大”、“减小”或“不变”).计算此时反应的平衡常数K=2.1(保留两位有效数字).
(3)联氨(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液时20%-30%的氢氧化钾溶液,现以联氨-空气燃料电池采用电解法制备N2O5,装置如图所示:

写出石墨1的电极反应式N2H4-4e-+4OH-=N2↑+4H2O;在电解池中电解的总反应化学方程式为N2O4+2HNO3$\frac{\underline{\;电解\;}}{\;}$2N2O5+H2↑.
分析 (1)已知:①N2(g)+2O2(g)═N2O4(I)△H1=-19.5kJ/mol
②N2O4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ/mol
根据盖斯定律②×2-①可得;
(2)①根据温度化学平衡的影响:温度升高向着吸热方向进行;
②根据增加氢气的物质的量化学平衡向着正反应方向移动;
③保持容器的体积、温度不变,再向容器内放入1mol N2、3molH2相当于再原平衡基础上增大压强,根据压强对化学平衡的影响分析;根据三段式计算平衡时各组分的浓度,代入K计算;
(3)根据图可知石墨1中N2O4失电子生成N2,结合电解质可写;电解池中四氧化二氮氧化为五氧化二氮,硝酸中的氢离子被还原为氢气.
解答 解:(1)已知:①N2(g)+2O2(g)═N2O4(I)△H1=-19.5kJ/mol
②N2O4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534.2kJ/mol
根据盖斯定律②×2-①可得;2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
故答案为:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-1048.9kJ/mol;
(2)①反应为放热反应,温度升高化学平衡向着吸热方向进行,从T1到T2生成物氨气的量增加,平衡正移,故T2<T1;
故答案为:<;
②b点代表平衡状态,c点又加入了氢气,故平衡向右移动,氮气的转化率增大;
故答案为:c;
③保持容器的体积、温度不变,再向容器内放入1mol N2、3molH2相当于再原平衡基础上增大压强,对于该反应,增大压强,平衡正向移动,氢气的转化率增大;
容器容积为1L,在起始体系中加入1molN2;H23mol,反应达到平衡时H2的转化率为60%;
N2(g)+3H2(g)?2NH3(g)
起始(mol/L):1 3 0
转化(mol/L):0.6 1.8 1.2
平衡(mol/L):0.4 1.2 1.2
则K=$\frac{1.{2}^{2}}{0.4×1.{2}^{3}}$=2.1;
故答案为:增大;2.1;
(3)根据图可知石墨1中N2O4失电子生成N2,电解质显碱性,则电极反应式为:N2H4-4e-+4OH-=N2↑+4H2O;电解池中四氧化二氮氧化为五氧化二氮,硝酸中的氢离子被还原为氢气,发生的反应为:N2O4+2HNO3$\frac{\underline{\;电解\;}}{\;}$2N2O5+H2↑;
故答案为:N2H4-4e-+4OH-=N2↑+4H2O;N2O4+2HNO3$\frac{\underline{\;电解\;}}{\;}$2N2O5+H2↑.
点评 本题考查了盖斯定律、化学平衡的有关计算、影响化学平衡的因素、电解池的工作原理知识,原电池原理分析,注意三段式解题方法和电化学中得失电子的分析,题目难度中等.

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 在铁制的炒锅、蒸锅等炊具上镀铜、防止生锈 | |
| B. | 地下钢铁管道连接镁块来防止钢铁锈蚀 | |
| C. | 健身器材刷油漆以防锈 | |
| D. | 洗衣机的滚筒采用不锈钢材料、既耐磨又耐腐蚀 |
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有 Ag2S 也有 AgCl | ||
| C. | 不能由黑色沉淀转变为白色沉淀 | D. | 只有 AgCl 白色沉淀 |
 N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用Ⅰ.CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)图1是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况.用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kj/mol、726.83kj/mol、285.2kj/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH).
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
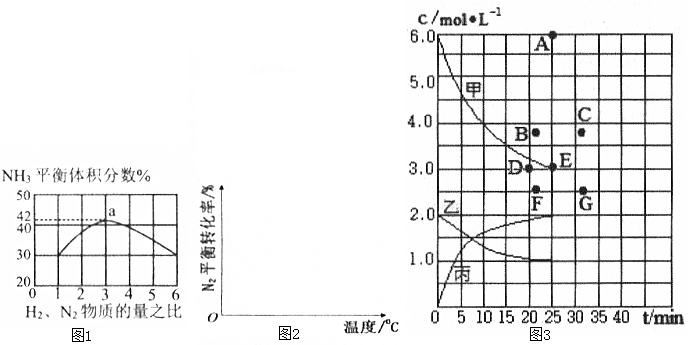
(1)已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.如图1表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系.
①工业上合成氨的温度一般控制在500℃,原因是该温度下催化剂的活性最好.
②根据图1中a点数据计算N2的平衡体积分数为14.5%,此时H2和N2的转化率之比为1:1.
(2)合成氨工业中,在其他条件相同时,请你画出N2的平衡转化率在不同压强(p1>p2)下随温度变化的曲线图.

(3)在500℃,反应N2(g)+3H2(g)?2NH3(g)中,将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表所示.
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| N(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| N(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol/L,此时v正大于v逆(填“大于”、“小于”或“等于”).
③根据上表中数据得到的“浓度-时间”关系可用如图3中曲线表示,其中表示c(N2)-t的曲线是乙(填“甲”、“乙”或“丙”).在此温度下,若起始充入4molN2和12mol H2,反应刚达到平衡时,氢气的浓度可用B点表示(从A~G点中选择).
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(I)?4NH3(g)+3O2(g),则其反应热△H=+1530 kJ•mol-1.(已知:2H2(g)+O2(g)=2H2O(I)△H=-571.6kJ•mol-1)
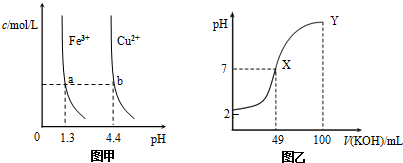
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |
| A. | 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体 | |
| B. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| C. | 新型能源生物柴油和矿物油主要化学成分相同 | |
| D. | 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁 |
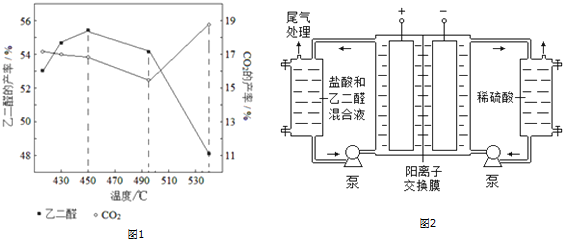
 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.