题目内容
4.CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.I、甲醇可以补充和部分替代石油燃料,缓解能源紧张.利用CO可以合成甲醇.
(1)已知:CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)═H2O(1)△H2=-285.8kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(1)△H3=-764.5kJ•mol-1
则CO(g)+2H2(g)═CH3OH(g)△H=-90.1kJ•mol-1
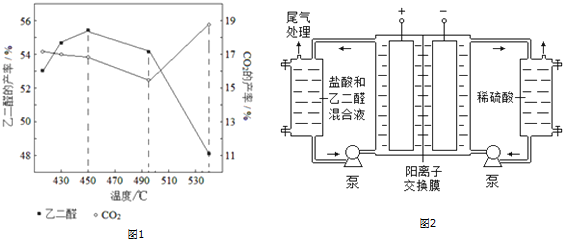
(2)一定条件下,在容积为VL的密闭容器中充入amol CO与2a mol H2合成甲醇平衡转化率与温度、压强的关系如图1所示.

①P1< P2(填“>”、“<”或“=”),理由是甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO的转化率提高
②该甲醇合成反应在A点的平衡常数K=$\frac{12{V}^{2}}{{a}^{2}}$(用a和V表示)
③该反应达到平衡时,反应物转化率的关系是:CO=H2(填“>”、“<”或“=”)
④下列措施中能够同时满足增大反应速率和提高CO转化率的是C.(填写相应字母)
A、使用高效催化剂 B、降低反应温度C、增大体系压强
D、不断将CH30H从反应混合物中分离出来E、增加等物质的量的CO和H2
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸.
(3)原电池法:
该小组设计的原电池原理如图2所示.
写出该电池负极的电极反应式SO2-2e-+2H2O═SO42-+4H+.
(4)电解法:
该小组用Na2SO3溶液充分吸收S02得到NaHSO3溶液,然后电解该溶液制得了硫酸.原理如图3所示.
写出开始电解时阳极的电极反应式HSO3-+H2O-2e-=SO42-+3H+.
分析 (1)根据CO(g)+2H2(g)═CH3OH(g),利用盖斯定律进行计算;
(2)①依据反应是气体体积减小的反应,相同温度下增大压强平衡正向进行;
②100°C时一氧化碳的转化率为0.75,结合平衡三段式列式根据平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$进行计算;
③根据转化率=$\frac{转化率}{起始量}$×100%来比较;
④根据增大浓度、温度、压强或者使用催化剂会增大反应速率以及平衡向正反应方向移动会提高CO转化率来判断;
(3)依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
(4)根据化合价变化判断阳极反应物质,写出阳极反应式.
解答 解:(1)①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(I)△H2=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(I)△H3=-764.5kJ•mol-1
由盖斯定律①+2×②-③得:CO(g)+2H2(g)═CH3OH(g),△H=(-283.0-285.8×2+764.5)kJ•mol-1=-90.1kJ•mol-1,
故答案为:-90.1;
(2)①图象分析可知相同温度下P2压强下一氧化碳转化率大于P1压强下一氧化碳转化率,反应是气体体积减小的反应,压强增大平衡正向进行,所以P1<P2;
故答案为:<;甲醇的合成反应是分子数减少的反应,相同温度下,增大压强CO的转化率提高;
②向VL恒容密闭容器中充入a mol CO与2a mol H2,100°C时一氧化碳的转化率为50%,
CO(g)+2H2(g)?CH3OH(g)
起始量(mol) a 2a 0
变化量(mol)0.75a 1.5a 0.75a
平衡量(mol)0.25a 0.5a 0.75a
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{\frac{0.75a}{V}}{\frac{0.25a}{V}(\frac{0.5a}{V})^{2}}$=$\frac{12{V}^{2}}{{a}^{2}}$,
故答案为:$\frac{12{V}^{2}}{{a}^{2}}$;
③因为转化率=转化量总量,又CO和H2按照系数比1:2消耗,而开始充入α molCO与2a molH2也刚好为1:2,所以CO的转化率等于H2的转化率,
故答案为:=;
④A、使用高效催化剂只能增大反应速率,不能改变平衡移动,所以CO的转化率不变,故A错误;
B、降低反应温度会减慢反应速率,故B错误;
C、增大体系压强,不仅增大反应速率,而且平衡也向正反应方向移动,所以CO的转化率也增大,故C正确;
D、不断将CH30H从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小,故D错误;
E、增加等物质的量的CO和H2,即增大反应物的浓度,反应速率增大,但增加了CO则CO的转化率也减小,故E错误;
故答案为:C;
(3)该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡影响因素的分析判断,平衡移动原理分析应用,原电池电极反应和电解池原理的理解应用,题目难度中等.

| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 铁屑在稀H2SO4作用下产生H2Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
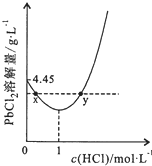 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |
(1)煤制天然气时会发生多个反应,生产过程中有多种途径生成CH4.
已知:C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
CO(g)+3H2(g)?CH4(g)+H2O(g)△H=-203kJ•mol-1
写出CO与H2O(g)反应生成H2和CO2的热化学方程式CO(g)+H2O(g)=H2(g)+CO2(g),△H=-41kJ/mol.
(2)天然气中含有H2S杂质,某科研小组用氨水吸收得到NH4HS溶液,
已知T℃,k(NH3•H2O)=1.74×10-5,k1(H2S)=1.07×10-7,k2(H2S)=1.74×10-13,NH4HS溶液中所含粒子浓度大小关系正确的是ac.
a.[NH4+]>[HS-]>[OH-]>[H+]b.[HS-]>[NH4+]>[S2-]>[H+]
c.[NH4+]>[HS-]>[H2S]>[H+]d.[HS-]>[S2-]>[H+]>[OH-]
(3)工业上常用CH4与水蒸气在一定条件下来制取H2,其原理为:CH4(g)+H2O(g)═CO(g)+3H2(g).
①该反应的逆反应速率表达式为:v=kc(CO)c3(H2),k为速率常数,在某温度下,测得实验数据如表:
| CO浓度(mol•L-1) | H2浓度(mol•L-1) | 逆反应速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
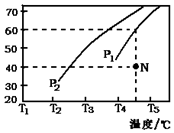
②在体积为2L的密闭容器中通入物质的量均为2mol的CH4和水蒸气,在一定条件下发生反应,测得H2的体积分数与温度及压强的关系如图2所示,则压强P1大于P2(填“大于”或“小于”);温度T3小于T4(填“大于”或“小于”);
③压强为P1时,在N点:v正大于v逆(填“大于”、“小于”或“等于”). 求N点对应温度下该反应的平衡常数K=48.
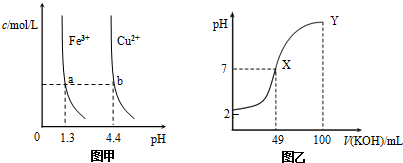
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
②若将1mol N2和3mol H2放入一密闭容器中在催化剂存在下进行反应,理论上放出或吸收的热量为Q1,而在实际生产中,放出或吸收的热量为Q2,Q1与Q2比较,正确的是A.
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2.