题目内容
9.某学习小组进行“铁与水反应所得固体物质的成分、性质及再利用”的实验探究.【探究一】设计下图所示装置进行“铁与水反应”的实验.
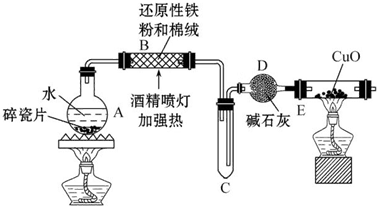
(1)反应前A中投放碎瓷片的目的是防暴沸.
(2)硬质玻璃管B中发生反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(3)装置E中的现象是黑色固体变红,右端管壁有水珠.
【探究二】设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分.
待硬质玻璃管B冷却后,取少许其中的固体物质溶于硫酸后,将所得溶液分成两份.
(4)一份滴加几滴KSCN溶液.若溶液变红色,推断硬质玻璃管B中固体物质的成分(选填序号,下同)为④;若溶液未变红色,推断硬质玻璃管B中固体物质的成分为③.
①只有有Fe ②只有Fe3 O4③Fe3 O4和Fe ④一定有Fe3 O4,可能有Fe
(5)若要检测溶液中是否存在Fe2+,则另一份溶液中需要加入酸性高锰酸钾溶液(填试剂)来检验
【探究三】设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数.
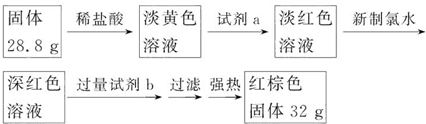
(6)计算反应后B装置中铁元素的质量分数为75.2%.
分析 【探究一】A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C收集氢气、D用于干燥氢气,E中氢气还原CuO;
(1)碎瓷片有防暴沸作用;
(2)高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气;
(3)CuO呈黑色、Cu呈红色;
【实验二】
(4)铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应;
(5)亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化;
【实验三】
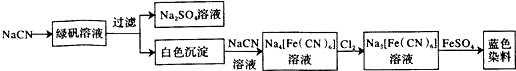
(6)B中固体和稀盐酸反应生成盐溶液,溶液呈黄色说明含有铁离子,加入KSCN溶液呈淡红色,则a为KSCN溶液,向溶液中加入氯水,氯水具有强氧化性,能氧化亚铁离子,加入氯水后溶液呈深紫红色,说明原溶液中含有亚铁离子,加入过量试剂b,过滤,则b为碱溶液,过滤得到氢氧化铁,加热氢氧化铁固体,氢氧化铁分解生成氧化铁,则红棕色固体是Fe2O3,根据Fe原子守恒计算Fe元素质量分数.
解答 解:【探究一】A中制取水蒸气,B中Fe和水蒸气反应生成四氧化三铁和氢气,C收集氢气、D用于干燥氢气,E中氢气还原CuO;
(1)碎瓷片有防暴沸作用,防止产生安全事故,
故答案为:防暴沸;
(2)高温条件下,Fe和水蒸气发生氧化还原反应生成四氧化三铁和氢气,反应方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)CuO呈黑色、Cu呈红色,氢气还原CuO得到Cu,且同时生成水,则看到的现象是黑色固体变红,右端管壁有水珠,
故答案为:黑色固体变红,右端管壁有水珠;
【实验二】
(4)铁离子和KSCN反应生成络合物而使溶液呈血红色,亚铁离子和KSCN不反应,向溶液中加入KSCN溶液呈红色,说明含有四氧化三铁,可能含有Fe;铁离子和Fe反应生成亚铁离子,不变红色说明固体中含有四氧化三铁和Fe,
故答案为:④;③;
(5)亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化,所以可以用酸性高锰酸钾溶液检验亚铁离子,故答案为:酸性高锰酸钾溶液;
【实验三】
(6)B中固体和稀盐酸反应生成盐溶液,溶液呈黄色说明含有铁离子,加入KSCN溶液呈淡红色,则a为KSCN溶液,向溶液中加入氯水,氯水具有强氧化性,能氧化亚铁离子,加入氯水后溶液呈深紫红色,说明原溶液中含有亚铁离子,加入过量试剂b,过滤,则b为碱溶液,过滤得到氢氧化铁,加热氢氧化铁固体,氢氧化铁分解生成氧化铁,则红棕色固体是Fe2O3,
n(Fe)=2n(Fe2O3)=2×$\frac{32g}{160g/mol}$=0.4mol,则w(Fe)=$\frac{56g/mol×0.4}{28.8g}$×100%=75.2%,
故答案为:75.2%.
点评 本题考查性质实验方案设计,为高频考点,涉及物质的量的计算、离子检验、实验操作等知识点,明确实验原理、物质性质、实验基本操作是解本题关键,题目难度不大.

| A. | $\frac{12n}{m}$ | B. | $\frac{60n}{m}$ | C. | $\frac{11m}{120n}$ | D. | $\frac{120n}{11m}$ |
| A. | c(H+)•c(OH- )乘积不变 | B. | pH增大了 | ||
| C. | c(OH- )降低了 | D. | 水电离出的c(H+)降低了 |
| A. | 无色强碱性溶液中可能大量存在 Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在 Na+、ClO?、SO42?、I? | |
| C. | 弱碱性溶液中可能大量存在 Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在 Ba2+、K+、Cl?、SO42? |
| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
| 选项 | A | B | C | D |
| 正极材料 | Zn | C | Zn | Mg |
| 负极材料 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | CuSO4 | CuSO4 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 甲烷在空气中燃烧 | B. | 碳酸钙受热分解 | ||
| C. | 镁条和盐酸反应 | D. | 氢氧化钠与盐酸反应 |
 .
. .
.
 .
. ,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.
,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.