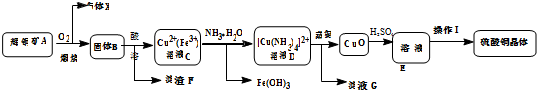
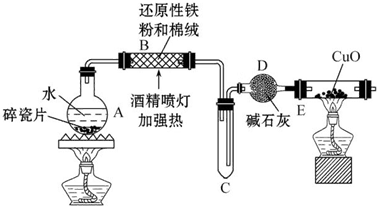
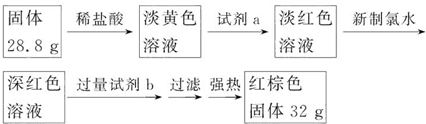
题目内容
19.若m克FeS2在氧气中完全燃烧生成SO2和Fe2O3时,转移的电子总数为n个,则阿伏加德罗常数可表示为( )| A. | $\frac{12n}{m}$ | B. | $\frac{60n}{m}$ | C. | $\frac{11m}{120n}$ | D. | $\frac{120n}{11m}$ |
分析 求出m克FeS2的物质的量,然后根据1molFeS2在氧气中完全燃烧生成SO2和Fe2O3时转移11mol电子来分析.
解答 解:m克FeS2的物质的量n=$\frac{m}{120}$mol,而1molFeS2在氧气中完全燃烧生成SO2和Fe2O3时,铁的价态由+2价变为+3价,S元素由-1价变为+4价,故1molFeS2转移11mol电子,则$\frac{m}{120}$molFeS2转移$\frac{11m{N}_{A}}{120}$个电子,即$\frac{11m{N}_{A}}{120}=n$,则NA=$\frac{120n}{11m}$.故选D.
点评 本题考查氧化还原反应的有关计算、阿伏伽德罗常数等,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
10.下列说法正确的是( )
| A. | Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | |
| B. | H2O2、Na202、SO2都具有漂白性且漂白原理相同 | |
| C. | 饱和Na2C03溶液中通入CO2溶液会变浑浊 | |
| D. | 可用石灰水吸收尾气中的S02气体 |
7.图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为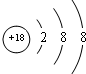
(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程
 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
11.下列微粒中,键角最大的是( )
| A. | NH4+ | B. | H3O+ | C. | CO2 | D. | CCl4 |
8.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 氢化物的稳定性H2Y>HZ | B. | 离子半径W3+<Z-,第一电离能X<W | ||
| C. | W、X、Y、Z最高正价与族序数相等 | D. | 电负性Z<Y<W<X |