题目内容
4.NA为阿伏伽德罗常数的值.下列说法正确的是( )| A. | 18gD2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L硫酸溶液中含有氢离子数目为NA | |
| C. | 标准状况下,22.4LSO3所含有的分子数目为NA | |
| D. | 过氧化钠与水反应时生成0.1mol氧气转移的电子数为0.2NA |
分析 A、求出重水的物质的量,然后根据重水中含10个质子来分析;
B、0.5mol硫酸溶液中氢离子的浓度为1mol/L;
C、标况下三氧化硫为固体;
D、过氧化钠和水的反应中,氧元素的价态由-1价变为0价.
解答 解:A、18g重水的物质的量为0.9mol,而重水中含10个质子,故0.9mol重水中含9NA个质子,故A错误;
B、0.5mol硫酸溶液中氢离子的浓度为1mol/L,故2L硫酸溶液中含有的氢离子的个数为2NA个,故B错误;
C、标况下三氧化硫为固体,故三氧化硫的物质的量不能根据气体摩尔体积来计算,故C错误;
D、过氧化钠和水的反应中,氧元素的价态由-1价变为0价,故当生成0.1mol氧气时,转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.下列条件下的反应,放出H2的速率最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 1.5mol/L H2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 3mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
16.已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是( )
| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |

 四氯化碳
四氯化碳 CO2
CO2 HClO
HClO 氯化铵
氯化铵 Na2O2
Na2O2

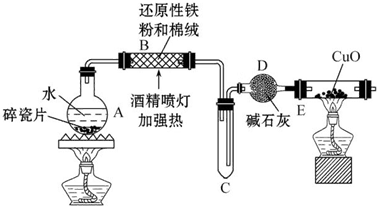
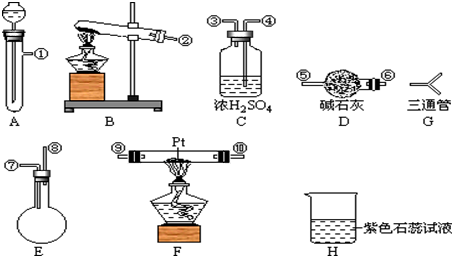
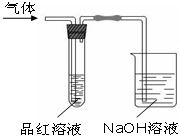 某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.