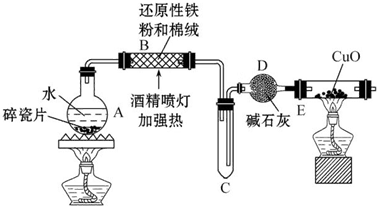
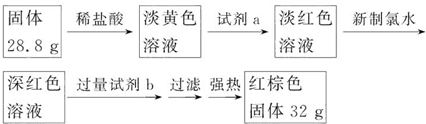
题目内容
17.下列有关溶液组成的描述合理的是( )| A. | 无色强碱性溶液中可能大量存在 Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在 Na+、ClO?、SO42?、I? | |
| C. | 弱碱性溶液中可能大量存在 Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在 Ba2+、K+、Cl?、SO42? |
分析 A.硫离子与铝离子发生双水解反应,铝离子、铵根离子与碱性溶液反应;
B.次氯酸根离子与酸性溶液中的氢离子反应,次氯酸根离子能够氧化碘离子;
C.碱性溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.钡离子与硫酸根离子反应生成硫酸钡沉淀.
解答 解:A.强碱性溶液中存在大量氢氧根离子,Al3+、NH4+与氢氧根离子反应,Al3+、S2?之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.酸性溶液中存在大量氢离子,ClO?与氢离子反应,ClO?、I?之间发生氧化还原反应,在溶液中不能大量共存,故B错误;
C.碳酸根离子水解显示弱碱性,Na+、K+、Cl?、CO32?之间不发生反应,在溶液中能够大量共存,故C正确;
D.Ba2+、SO42?之间反应生成难溶物硫酸钡,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
7.图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为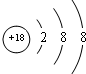
(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程 .
.
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)地壳中含量最多的金属元素的名称是铝
(3)用电子式表示②与④形成化合物的过程
 .
.(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4(用化学式作答,下同),碱性最强的是KOH.
(5)写出⑤与氢氧化钠反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:Al (OH)3+OH-=AlO2-+2H2O.
(6)②和⑥,②和⑨形成的化合物含有的化学键类型分别是共价键,离子键.
8.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 氢化物的稳定性H2Y>HZ | B. | 离子半径W3+<Z-,第一电离能X<W | ||
| C. | W、X、Y、Z最高正价与族序数相等 | D. | 电负性Z<Y<W<X |
5.下列有关“化学与生活”的叙述不正确的是( )
| A. | 漂白粉漂白织物利用了物质氧化性 | |
| B. | 点燃爆竹后,硫燃烧生成SO2 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | PX项目的主要产品对二甲苯属于不饱和烃 |
12.下列条件下的反应,放出H2的速率最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 1.5mol/L H2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 3mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
6.化学反应总是伴随着丰富多彩的颜色的变化,下列说法错误的是( )
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| C. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
7.下列用以表示原电池或电解池中物质变化的化学用语中,不正确的是( )
| A. | 钢铁发生电化学腐蚀的负极反应式是Fe-2e-═Fe2+ | |
| B. | 甲醇燃料电池在碱性介质中的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 分别用铁棒作阳极、碳棒作阴极电解氯化铜溶液的离子方程式为:2Cl-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Cu↑+Cl2↑ | |
| D. | 电解熔融氯化镁时,阳极的电极反应式为2Cl--2e-═Cl2↑;阴极的电极反应式为Mg2++2e-═Mg |