题目内容
1.W、X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2、MY3两种分子;X的气态氢化物水溶液呈碱性.请回答下列问题:
(1)Y在元素周期表中的位置为第二周期ⅥA族,上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),W、Y、Z、M形成的简单离子的半径大小顺序是S2->O2->Na+>H+(用化学符号表示),G的离子结构示意图:
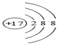 .
.(2)Y与M的氢化物中,热稳定性更好的是H2O(填化学式),原因是O的非金属性大于S.
(3)Z2Y2的电子式为
 ,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.
,ZW与水反应放出气体的化学方程式为NaH+H2O═NaOH+H2↑.(4)X2W4可作为新型燃料电池的燃料,在氧气中燃烧生成氮气和水,请利用X2W4、氧气与KOH溶液组成碱性燃料电池,写出该电池负极的电极反应式N2H4-4e-+4OH-═N2↑+4H2O,指出电解质溶液中OH-离子向负极移动.
分析 W、X、Y、Z、M、G六种元素分属三个短周期,原子序数依次增大,则W应为H元素,X元素的气态氢化物水溶液呈碱性,则X为N元素;Y、M同主族,可形成MY2、MY3两种分子,则M为S元素、Y为O元素,W、Z同主族,可形成离子化合物ZW,Z的原子序数小于S,应为Na元素,G原子序数大于S原子序数,则G为Cl元素,以此解答该题.
解答 解:(1)O元素在元素周期表中的位置为第二周期ⅥA族,上述元素的最高价氧化物对应的水化物酸性最强的是氯对应最高价氧化物的水化物HClO4,H、O、Na、S形成的简单离子的半径大小顺序是S2->O2->Na+>H+,氯离子结构示意图: ,故答案为:第二周期ⅥA族;HClO4;S2->O2->Na+>H+;
,故答案为:第二周期ⅥA族;HClO4;S2->O2->Na+>H+; ;
;
(2)O的非金属性大于S,非金属性越强氢化物越稳定,所以水稳定,故答案为:H2O;O的非金属性大于S;
(3)Z2Y2是过氧化钠,其电子式为 ,NaH与水反应生成氢氧化钠和氢气,反应方程式为:NaH+H2O═NaOH+H2↑,
,NaH与水反应生成氢氧化钠和氢气,反应方程式为:NaH+H2O═NaOH+H2↑,
故答案为: ;NaH+H2O═NaOH+H2↑;
;NaH+H2O═NaOH+H2↑;
(4)肼-空气燃料电池是一种碱性燃料电池工作时,负极上肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-═N2↑+4H2O,正极上发生得电子的还原反应,即2H2O+O2+4e-═4OH-,溶液中OH-离子向负极,故答案为:N2H4-4e-+4OH-═N2↑+4H2O;负.
点评 本题考查结构性质位置关系应用,为高频考点,涉及半径比较、元素周期律、原电池、元素化合物推断等,推断元素是解题关键,注意对基础知识的理解掌握,难度中等.

练习册系列答案
相关题目
11.下列微粒中,键角最大的是( )
| A. | NH4+ | B. | H3O+ | C. | CO2 | D. | CCl4 |
12.下列条件下的反应,放出H2的速率最快的是( )
| 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | |||
| A | Mg | 0.1 | 1.5mol/L H2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/L HCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/L CH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 3mol/L HNO3 | 10 | 20℃ |
| A. | A | B. | B | C. | C | D. | D |
16.已知下列元素原子的最外层电子排布式,其中不能表示该元素一定为主族元素的是( )
| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |
6.化学反应总是伴随着丰富多彩的颜色的变化,下列说法错误的是( )
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| C. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
11.“盐水动力”玩具车的电池以镁片、活性炭为电极,向极板上滴加食盐水后电池便可工作,电池反应为2Mg+O2+2H2O=2Mg(OH)2.下列关于该电池的说法错误的是( )
| A. | 镁片作为负极 | B. | 正极发生氧化反应 | ||
| C. | 电池工作时镁片逐渐被消耗 | D. | 食盐水作为电解质溶液 |
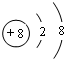 ,D在元素周期表中的位置第二周期VIA族.
,D在元素周期表中的位置第二周期VIA族.  .
.