题目内容
18.某原电池的总反应式是Zn+Cu2+═Zn2++Cu,该反应的原电池的正确组成是( )| 选项 | A | B | C | D |
| 正极材料 | Zn | C | Zn | Mg |
| 负极材料 | Cu | Zn | Ag | Zn |
| 电解质溶液 | CuCl2 | CuSO4 | CuSO4 | CuCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 Zn+Cu2+=Zn2++Cu中,Zn失去电子,为原电池的负极,正极材料为比Zn不活泼的金属或惰性电极即可,电解质溶液中含铜离子,以此来解答.
解答 解:原电池的总反应是Zn+Cu2+=Zn2++Cu,Zn失去电子,为原电池的负极,正极材料为比Zn不活泼的金属或惰性电极即可,电解质溶液中含铜离子,则可选Zn为负极,Fe为正极,电解质溶液为CuCl2或是CuSO4,故B正确.
故选B.
点评 本题考查原电池的设计,注意利用电池反应中得失电子分析电极,题目就有较大的开放性,注重知识的迁移应用,题目难度不大.

练习册系列答案
相关题目
8.已知短周期元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | 氢化物的稳定性H2Y>HZ | B. | 离子半径W3+<Z-,第一电离能X<W | ||
| C. | W、X、Y、Z最高正价与族序数相等 | D. | 电负性Z<Y<W<X |
6.化学反应总是伴随着丰富多彩的颜色的变化,下列说法错误的是( )
| A. | 将Na2O2固体投入滴加了少许酚酞的蒸馏水中,溶液先变红后褪色 | |
| B. | 向胆矾晶体(CuSO4•5H2O)滴加浓硫酸,晶体由蓝色变为黑色 | |
| C. | 用玻璃棒蘸取浓硝酸滴加到pH试纸上,试纸先变红后变成白色 | |
| D. | 将SO2通入品红溶液中,溶液颜色褪去,加热后又变成红色 |
3.能够说明氯的非金属性比硫强的事实有( )
①HCl酸性强于H2S的酸性
②将氯气通入H2S溶液中可置换出硫
③氯气与铁反应生成FeCl3,硫与铁反应生成FeS
④硫和氯变成简单阴离子时硫原子得到的电子更多
⑤氯气和氢气的混合气,经强光照射可剧烈反应,而硫与氢气反应需较高温度.
①HCl酸性强于H2S的酸性
②将氯气通入H2S溶液中可置换出硫
③氯气与铁反应生成FeCl3,硫与铁反应生成FeS
④硫和氯变成简单阴离子时硫原子得到的电子更多
⑤氯气和氢气的混合气,经强光照射可剧烈反应,而硫与氢气反应需较高温度.
| A. | ②③⑤ | B. | ①③⑤ | C. | ①②③ | D. | ①②③⑤ |
7.下列用以表示原电池或电解池中物质变化的化学用语中,不正确的是( )
| A. | 钢铁发生电化学腐蚀的负极反应式是Fe-2e-═Fe2+ | |
| B. | 甲醇燃料电池在碱性介质中的正极反应式为:O2+2H2O+4e-═4OH- | |
| C. | 分别用铁棒作阳极、碳棒作阴极电解氯化铜溶液的离子方程式为:2Cl-+Cu2+$\frac{\underline{\;通电\;}}{\;}$Cu↑+Cl2↑ | |
| D. | 电解熔融氯化镁时,阳极的电极反应式为2Cl--2e-═Cl2↑;阴极的电极反应式为Mg2++2e-═Mg |
8.下列叙述中错误的是( )
| A. | 乙烯和苯使溴水褪色的原理不同 | |
| B. | 乙烯和聚乙烯中都有碳碳双键 | |
| C. | 煤的气化和液化都是化学变化 | |
| D. | 甲烷中混有乙烯时,仅用酸性KMnO4溶液不能提纯 |
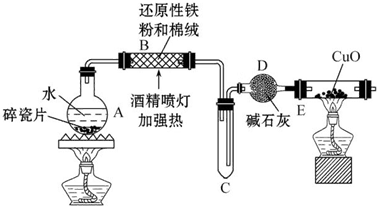
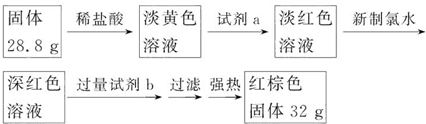
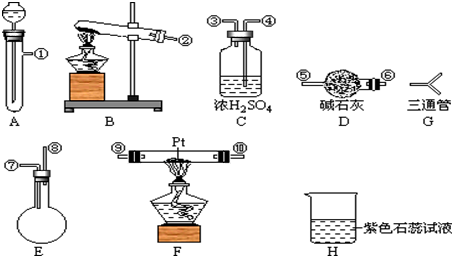
 ,D在元素周期表中的位置第二周期VIA族.
,D在元素周期表中的位置第二周期VIA族.  .
.