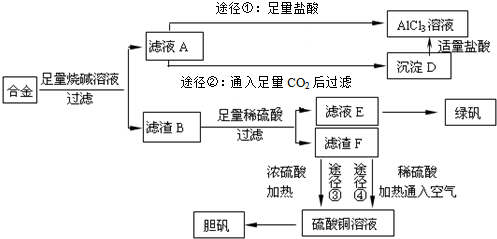
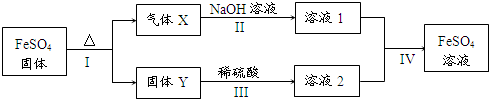
题目内容
19.对于平衡体系mA(g)+nB(g)═pC(g)+qD(g)△H<0.下列结论中错误的是( )| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
分析 A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,可知增大压强,平衡逆向移动;
B.若平衡时,A、B的转化率相等,则起始物质的量之比等于化学计量数之比;
C.若m+n=p+q,可知反应前后气体的物质的量不变;
D.m+n=p+q时,压强增大到原来的2倍,则总体积变为原来的$\frac{1}{2}$.
解答 解:A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,可知增大压强,平衡逆向移动,则m+n<p+q,故A正确;
B.若平衡时,A、B的转化率相等,则起始物质的量之比等于化学计量数之比,则说明反应开始时,A、B的物质的量之比为m:n,故B正确;
C.若m+n=p+q,可知反应前后气体的物质的量不变,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a,故C正确;
D.m+n=p+q时,压强增大到原来的2倍,则总体积变为原来的$\frac{1}{2}$,若m+n≠p+q时,压强增大到原来的2倍,达到新平衡时,总体积比原来的$\frac{1}{2}$要小,故D错误;
故选D.
点评 本题考查化学平衡的移动,为高频考点,把握温度、浓度、压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意气体的化学计量数的关系,题目难度不大.

练习册系列答案
相关题目
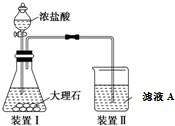
14. 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).
附表 相关物质的沸点(101kPa)
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机层用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机层,收集相应馏分.
(1)实验装置中冷凝管的主要作用是冷凝回流,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3.
(3)步骤2中用10%NaHCO3溶液洗涤有机层,是为了除去溶于有机层的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置如图,相关物质的沸点见附表).附表 相关物质的沸点(101kPa)
| 物质 | 沸点/℃ | 物质 | 沸点/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 间溴苯甲醛 | 229 |
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓H2SO4干燥过的液溴,保温反应一段时间,冷却.
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液.有机层用10%NaHCO3溶液洗涤.
步骤3:经洗涤的有机层加入适量无水MgSO4固体,放置一段时间后过滤.
步骤4:减压蒸馏有机层,收集相应馏分.
(1)实验装置中冷凝管的主要作用是冷凝回流,锥形瓶中的溶液应为NaOH.
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为AlCl3.
(3)步骤2中用10%NaHCO3溶液洗涤有机层,是为了除去溶于有机层的Br2、HCl(填化学式).
(4)步骤3中加入无水MgSO4固体的作用是除去有机相的水.
(5)步骤4中采用减压蒸馏技术,是为了防止间溴苯甲醛被氧化.
4.下列说法正确的是( )
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
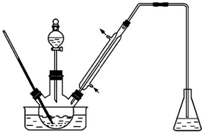
11.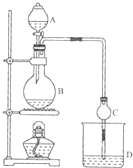 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有 关有机物的沸点:
请回答:
(1)从实验安全考虑,B瓶中除了加反应液外,还需加入沸石;若用同位素18O示踪 法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H218O
(2)球形干燥管C的作用是防倒吸.若反应前向D中加入几滴酚酞,溶液 呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O=HCO3-+OH-;反应结束后D 中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)B,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷B.无水硫酸钠C.碱石灰D.生石灰
(4)蒸馏时需要的玻璃仪器有:酒精灯、蒸馏烧瓶、冷凝管、温度计、接收器、锥形瓶.
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH
②有 关有机物的沸点:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
(1)从实验安全考虑,B瓶中除了加反应液外,还需加入沸石;若用同位素18O示踪 法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:CH3CO18OH+C2H5OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H218O
(2)球形干燥管C的作用是防倒吸.若反应前向D中加入几滴酚酞,溶液 呈红色,产生此现象的原因是(用离子方程式表示)CO32-+H2O=HCO3-+OH-;反应结束后D 中的现象是溶液分层,上层无色油体液体,下层溶液颜色变浅.
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出乙醇;再加入(此空从下列选项中选择)B,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯.
A.五氧化二磷B.无水硫酸钠C.碱石灰D.生石灰
(4)蒸馏时需要的玻璃仪器有:酒精灯、蒸馏烧瓶、冷凝管、温度计、接收器、锥形瓶.
9.下列过程中,需要吸收能量的是( )
| A. | I2→I+I | B. | H+Cl=HCl | C. | H+H=H2 | D. | S+O2=SO2 |