题目内容
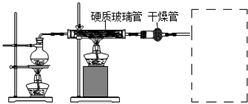
8.掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图1为两套实验装置.
(1)写出下列仪器的名称:①蒸馏烧瓶,④1000mL容量瓶.
(2)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有温度计,冷凝管的进水口是g
(填“f”或“g”);
(3)某校环保兴趣小组在处理污水样品时,需用质量分数为37%、密度为1.19g/cm3的浓盐酸配制成250mL 0.1mol•L-1的稀盐酸溶液.装置Ⅱ是某同学转移溶液的示意图,图Ⅱ中的错误是缺少玻璃棒引流.
①盛放浓盐酸溶液的试剂瓶标签上应印有下列如图2警示标记中的D.
②在如图3所示仪器中,配制上述溶液不需要的是C(填如图相应仪器的序号);
③根据计算,本实验需要量取浓盐酸的体积为8.3mL,本实验量筒应使用的是A(在横线上填写相应的序号,否则无分,下同)
A.10mL B.100mL C.250mL D.500mL
④在容量瓶的使用方法中,下列操作正确的是AE.
A.使用容量瓶前检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
⑤若定容后摇匀静置,发现凹液面低于刻度线,此时应该A.
A.直接转移到细口试剂瓶中 B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制 D.直接贮存于容量瓶中
⑥假设配制时其他操作均正确,只出现以下某一情况,试判断所配制的溶液浓度相比于要求的值(即0.1mol/L)如何.(a、偏高;b、偏低;c、无影响,在下列横线上填相应序号)
A.容量瓶中有少量蒸馏水c
B.稀释浓HCl时,没有冷却就立即转移到容量瓶中a
C.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中b
D.若定容时俯视,所配溶液的物质的量浓度a.
分析 (1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,溶液配制一定需要容量瓶、玻璃棒等,根据仪器的结构特点判断;
(2)分离四氯化碳和酒精的混合物必须用酒精灯加热,需要温度计测定馏分的温度;冷水下进上出;
(3)图中需要玻璃棒引流;
①浓盐酸溶液具有腐蚀性;
②根据配制一定物质的量浓度的溶液使用的仪器分析需要的仪器和缺少的仪器;
③根据c=$\frac{1000ρw}{M}$计算出需要浓盐酸的浓度,再根据配制1000mL 0.1mol•L-1的盐酸溶液需要的氯化氢的物质的量计算出需要的体积;根据计算结果选择量筒规格;
④根据容量瓶的正确使用方法进行判断;容量瓶有瓶塞,配制过程中需要摇匀,所以实验前必须检查容量瓶是否漏水;
⑤若定容后摇匀静置,发现凹液面低于刻度线,属于正常现象,应该将溶液直接转移到细口试剂瓶中;
⑥根据c=$\frac{n}{V}$,误差分析时,关键要看配制过程中引起n和V怎样的变化,若n比理论值小或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)蒸馏装置中的主要仪器有蒸馏烧瓶、冷凝管、牛角管、锥形瓶,酒精灯,由图可知①为蒸馏烧瓶,溶液配制一定需要容量瓶、玻璃棒等,则④为1000mL容量瓶,
故答案为:蒸馏烧瓶;1000mL容量瓶;
(2)分离四氯化碳和酒精的混合物用蒸馏的方法分离,图中缺少温度计,冷凝管的进水口是g,
故答案为:温度计;g;
(3)图Ⅱ中的错误是缺少玻璃棒引流,故答案为:缺少玻璃棒引流;
①盛放浓盐酸溶液的试剂瓶标签上应印有下列如图2警示标记中的D,故答案为:D;
②在如图3所示仪器中,配制上述溶液需要容量瓶、玻璃棒、烧杯、量筒、胶头滴管,不需要的是分液漏斗,故答案为:C;
③质量分数为37%的浓盐酸(密度为1.19g/cm3)的物质的量浓度为:c=$\frac{1000ρw}{M}$=$\frac{1000×1.19×37%}{36.5}$≈12.1(mol/L),所需浓盐酸体积V=$\frac{0.1mol/L×1L}{12.1mol/L}$=0.0083mL=8.3mL,量取8.3mL浓盐酸,需要选择10mL量筒,
故答案为:8.3;A;
④A.使用容量瓶前检查它是否漏水,漏水不能使用,故A正确;
B.容量瓶用水洗净后,不能用稀HCl溶液润洗,故B错误;
C.配制溶液时,不能在容量瓶中溶解,故C错误;
D.配制溶液时,若试样是液体,不能在容量瓶中稀释,故D错误;
E、盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀,操作合理,故E正确;
故答案为:AE;
⑤若定容后摇匀静置,发现凹液面低于刻度线,此时应该直接转移到细口试剂瓶中,其它选项均不合理,故答案为:A;
⑥A.容量瓶中有少量蒸馏水,对实验无影响,浓度不变,故答案为:c;
B.稀释浓HCl时,没有冷却就立即转移到容量瓶中,V偏小,则浓度偏高,故答案为:a;
C.配制的溶液装入洁净的但有少量蒸馏水的试剂瓶中,溶液的浓度偏低,故答案为:b;
D.若定容时俯视,V偏小,所配溶液的物质的量浓度偏高,故答案为:a.
点评 本题考查配制一定物质的量浓度的溶液,为高频考点,把握溶液配制的步骤、操作、仪器及误差分析为解答的关键,侧重分析与实验能力的考查,注意结合公式及不当操作分析误差,题目难度不大.

| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
2H2(g)+O2(g)═2H2O(l)△H4.
下列大小关系正确的是( )
| A. | △H2>△H1,△H4>△H3 | B. | △H1>△H2,△H4>△H3 | C. | △H1>△H2,△H3>△H4 | D. | △H2>△H1,△H3>△H4 |
| A. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 | |
| B. | 用蒸发的方法使NaCl从溶液中析出时,玻璃棒的作用是引流 | |
| C. | 蒸馏操作时,应使温度计水银球插入蒸馏烧瓶的液面以下 | |
| D. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| A. | 钠在氯气中燃烧 | B. | 二氧化碳通入澄清的石灰水中 | ||
| C. | 氯化钠溶液中滴加硝酸银溶液 | D. | 锌粒放入稀硫酸中 |
| A. | 1L pH=l的硫酸溶液中含有的H+数目为0.2NA | |
| B. | 1 mol羟基与l mol氢氧根离子所含质子数均为9NA | |
| C. | 14 g由N2与CO组成的混合气体中含有的原子数目为2NA | |
| D. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA |
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |