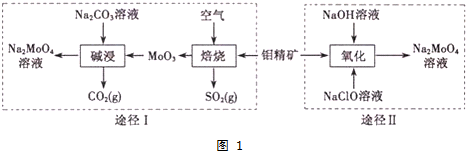
题目内容
9.下列过程中,需要吸收能量的是( )| A. | I2→I+I | B. | H+Cl=HCl | C. | H+H=H2 | D. | S+O2=SO2 |
分析 A、断开化学键吸热;
B、形成化学键放热;
C、形成化学键放热;
D、硫燃烧生成二氧化硫放热.
解答 解:A、断开化学键吸热,即碘单质断裂生成碘原子为吸热过程,故A正确;
B、形成化学键放热,即氯原子和氢原子结合生成氯化氢为放热过程,故B错误;
C、形成化学键放热,即氢原子结合生成氢气为放热过程,故C错误;
D、硫燃烧生成二氧化硫放热,故D错误;
故选A.
点评 本题考查了化学反应的本质,化学键断裂吸热,化学键形成放热,燃烧反应,中和反应,化合反应等分析应用,题目较简单.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
19.对于平衡体系mA(g)+nB(g)═pC(g)+qD(g)△H<0.下列结论中错误的是( )
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
20.下列反应既是氧化还原反应又是离子反应的是( )
| A. | 钠在氯气中燃烧 | B. | 二氧化碳通入澄清的石灰水中 | ||
| C. | 氯化钠溶液中滴加硝酸银溶液 | D. | 锌粒放入稀硫酸中 |
17.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1L pH=l的硫酸溶液中含有的H+数目为0.2NA | |
| B. | 1 mol羟基与l mol氢氧根离子所含质子数均为9NA | |
| C. | 14 g由N2与CO组成的混合气体中含有的原子数目为2NA | |
| D. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA |
4.单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备.
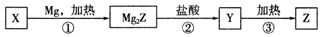
其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似.下列说法错误的是( )

其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似.下列说法错误的是( )
| A. | X可以和氢氟酸反应 | |
| B. | 甲烷的稳定性比Y强 | |
| C. | Z是将太阳能转换为电能的常用材料 | |
| D. | 上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应 |
14.有关水在人体中的作用,下列说法不正确的是( )
| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |
18.下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |