题目内容
4.下列说法正确的是( )| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
分析 A.△H-T△S<0为判断反应进行的综合判据;
B.对于能够自发进行的吸热反应,△H>0,且△H-T△S<0;
C.△H-T△S<0的反应可自发进行;
D.催化剂只改变反应速率,不改变反应的方向.
解答 解:A.△H-T△S<0为判断反应进行的综合判据,则焓变或熵变不能单独作为反应自发性的判据,故A错误;
B.对于能够自发进行的吸热反应,△H>0,且△H-T△S<0,则体系有自发地向混乱度增加的方向转变的倾向,即△S>0,故B正确;
C.△H-T△S<0的反应可自发进行,则△H<0、△S>0的反应在温度低时能自发进行,故C错误;
D.使用催化剂,不能改变化学反应进行的方向,故D错误;
故选B.
点评 本题考查反应热与焓变,为高频考点,把握判断反应进行的判据为解答的关键,侧重分析与应用能力的考查,注意不能单独使用焓变、熵变判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)?3C(g)+D(g),达到平衡,C的浓度为w mol/L.若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
15.某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)?D(g)+E(g)△H=QkJ•mol-1.在T1℃时,反应进行到不同时间测得各物质的物质的量如表:
(1)T1℃时,该反应的平衡常数K=0.25;
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).

(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是ae(填字母编号).
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积
d.升高反应体系温度 e.同时加入0.2molB、0.1molD、0.1molE
(3)对于该反应,用各物质表示的反应速率与时间的关系示意曲线为图1中的④(填序号).

(4)维持容器的体积和温度T1不变,当向该容器中加入1.60 mol B、0.20 mol D、0.20 mol E和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n的取值范围是>0.3.
(5)维持容器的体积和温度T1不变,各物质的起始物质的量为n(A)=1.0 mol,n(B)=3.0 mol,n(D)=a mol,达到平衡后,n(E)=0.50 mol,则a=1.5.
(6)若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图2所示.由图可知,Q小于0(填“大于”或“小于”),c点v正等于v逆(填“大于”“小于”或“等于”).
12.世间万物都有它的两面性,氰化钠(NaCN)是一种重要的化工原料,常用于化学合成、冶金工业等,应用不当,也会引起严重的后果.
(1)工业上可用纯碱、焦炭、氨气在高温下反应可以制取NaCN,写出反应的化学方程式Na2CO3+C+2NH3=2NaCN+3H2O.
(2)工业利用NaCN制备蓝色染料的流程如下:
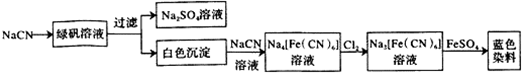
通入Cl2时发生反应的离子方程式为_2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-_,该蓝色染料的化学式为Fe3[Fe(CN)6]2.
(3)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.浸取过程的氧化剂是O2.
(4)上述方法的主要缺点是容易引起水体污染.天津“8.12“爆炸中扩散的CN-也造成了部分水体污染.某小组欲检测污水中CN-的浓度.
资料:碱性条件下发生离子反应:2CN-+5H2O2+2OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
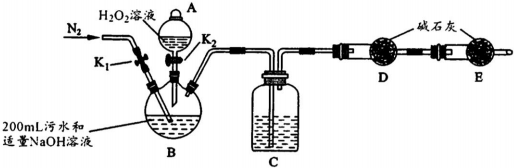
①加入药品之前的操作是检查装置气密性;B的名称是三颈瓶,C中试剂是浓H2S04.
②实验步骤如下:
③为了使检测更加准确,上述(2)中操作要特别注意一些事项.请写出至少一条加稀H2S04时要缓慢注入(要缓慢通人N2或给B加热时温度不能过高或加入稀H2SO4,要足量);.
(5)常温下HCN的电离常数Ka=6.2×10-10,浓度均为0.5mol/L的NaCN和HCN的混合溶液显碱(填“酸”、“碱”或“中”)性,通过计算说明其原因Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性.
(1)工业上可用纯碱、焦炭、氨气在高温下反应可以制取NaCN,写出反应的化学方程式Na2CO3+C+2NH3=2NaCN+3H2O.
(2)工业利用NaCN制备蓝色染料的流程如下:

通入Cl2时发生反应的离子方程式为_2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-_,该蓝色染料的化学式为Fe3[Fe(CN)6]2.
(3)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.浸取过程的氧化剂是O2.
(4)上述方法的主要缺点是容易引起水体污染.天津“8.12“爆炸中扩散的CN-也造成了部分水体污染.某小组欲检测污水中CN-的浓度.
资料:碱性条件下发生离子反应:2CN-+5H2O2+2OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略).(不考虑污水中其它离子反应)

①加入药品之前的操作是检查装置气密性;B的名称是三颈瓶,C中试剂是浓H2S04.
②实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
(5)常温下HCN的电离常数Ka=6.2×10-10,浓度均为0.5mol/L的NaCN和HCN的混合溶液显碱(填“酸”、“碱”或“中”)性,通过计算说明其原因Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性.
19.对于平衡体系mA(g)+nB(g)═pC(g)+qD(g)△H<0.下列结论中错误的是( )
| A. | 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a | |
| D. | 若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的$\frac{1}{2}$要小 |
16.已知热化学方程式:
S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
2H2(g)+O2(g)═2H2O(l)△H4.
下列大小关系正确的是( )
S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
2H2(g)+O2(g)═2H2O(g)△H3
2H2(g)+O2(g)═2H2O(l)△H4.
下列大小关系正确的是( )
| A. | △H2>△H1,△H4>△H3 | B. | △H1>△H2,△H4>△H3 | C. | △H1>△H2,△H3>△H4 | D. | △H2>△H1,△H3>△H4 |
14.有关水在人体中的作用,下列说法不正确的是( )
| A. | 水是一种很好的溶剂 | B. | 水在人体内还有调节体温的作用 | ||
| C. | 饮用水越纯净对身体越好 | D. | 水是反应介质和反应物 |