题目内容
12. 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:(1)若该微粒呈电中性,一般不与其他原子反应,这种微粒名称是氩.
(2)若该微粒带一个单位负电荷,这种微粒的符号是氯离子;该元素在周期表中的位置为第三周期,第ⅤⅡA族.
(3)若该微粒带一个单位正电荷,这种微粒的原子核内有19个质子.
分析 (1)根据微粒呈电中性,及微粒化学性质稳定说明是具有稳定结构的原子;
(2)阴离子:质子数=核外电子数-电荷数;周期数=电子层数,主族数=最外层电子数;
(3)阳离子:质子数=核外电子数+电荷数.
解答 解:(1)根据题意可知:微粒呈电中性,且微粒化学性质稳定,说明是具有稳定结构的原子,质子数等于核外电子数=18,故该粒子为氩,故答案为:氩;
(2)该微粒带一个单位负电荷,则该微粒的质子数=18-1=17,故该微粒为氯离子,氯元素位于周期表的第三周期,第ⅤⅡA族,故答案为:氯离子;第三周期第ⅤⅡA;
(3)该微粒带一个单位正电荷,则该微粒的质子数=18+1=19,故答案为:19.
点评 本题考查学生对原子结构示意图及其特点的理解与掌握,难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
2.有关元素周期表的说法中错误的是( )
| A. | 元素周期表中第16个纵行表示为ⅥA | |
| B. | ⅦA元素也称为卤族元素 | |
| C. | 元素周期表中,Ⅷ包括第8,9,10纵行 | |
| D. | 0族元素的原子最外层电子数为8,元素化合价为0 |
3.已知(NH4)2SO4和(NH4)2HPO4的混合物中含氮量为21%,则混合物中含氧量约为( )
| A. | 42% | B. | 48% | C. | 81% | D. | 无法确定 |
20.下列电子式书写正确的是( )
| A. |  | B. |  | C. |  | D. |  |
7.下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤(NH4)2CO3.
①NaHCO3②Al2O3③Al(OH)3 ④Al ⑤(NH4)2CO3.
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
2.已知下列热化学方程式:
(l) C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=△H1
(2)2H2(g)+O2(g)=2H2O(g)△H=△H2
由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3.则△H3等于( )
(l) C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=△H1
(2)2H2(g)+O2(g)=2H2O(g)△H=△H2
由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3.则△H3等于( )
| A. | △H1-△H2 | B. | △H1-$\frac{1}{2}$△H2 | C. | 2△H1-△H2 | D. | $\frac{1}{2}$△H2-△H1 |

 ,A的电子式为
,A的电子式为 .
. +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$ +H2O.
+H2O.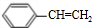 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
.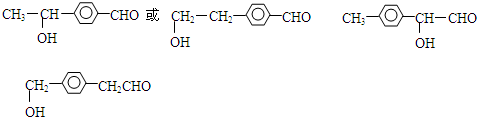 任意一种.(写出一种即可)
任意一种.(写出一种即可)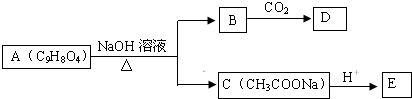
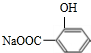 .
.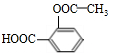 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$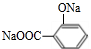 +CH3COONa+2H2O.
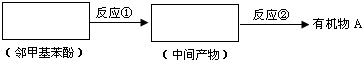
+CH3COONa+2H2O.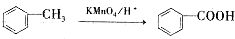 ,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)
,且苯酚和乙酸在一定条件下能发生酯化反应.请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式(其中反应①条件为CH3COOH/浓H2SO4;反应②的条件为KMnO4/H+)