题目内容
20.下列电子式书写正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 简单阳离子的电子式为其离子符合,复杂的阳离子电子式除应标出共用电子对、非共用电子对等外,还应加中括号,并在括号的右上方标出离子所带的电荷.无论是简单阴离子,还是复杂的阴离子,都应标出电子对等,还应加中括号,并在括号的右上方标出离子所带的电荷. 离子化合物电子式的书写,是将阴阳离子(阳离子在前,阴离子在后)拼在一起.对于不同价态的离子,也按其绝对值,遵照“大值在中间、小值在周边”的原则书写;
以共价键形成的物质,必须正确地表示出共用电子对数,并满足每个原子的稳定结构,共价化合物电子式的书写,一般为正价者在前.对于不同价态的元素的原子,一般将化合价绝对值大的写在中间,绝对值小的写在周边.
解答 解:A.Na2O是钠离子和氧离子之间通过离子键形成的离子化合物,所属的晶体类型是离子晶体,电子式为 ,故A错误;
,故A错误;
B.H2S为共价化合物,硫原子中最外层有8个电子达到稳定结构,分子中存在两个H-S键,电子式为: ,故B错误;
,故B错误;
C.硫原子与碳原子之间形成2对共用电子对,电子式为 ,故C正确;
,故C正确;
D.氢氧化钡的电子式为: ,故D错误.
,故D错误.
故选C.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
10.最外层电子数为4的原子,其荷电核数可能为( )
| A. | 8 | B. | 14 | C. | 7 | D. | 17 |
8.LiOH常用于制备锂离子电池正极材料.工业上常利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法正确的是( )

| A. | a是电源的负极 | |
| B. | B极区电解液为LiOH溶液 | |
| C. | A电极的电极反应式为4OH--4e-=2H2O+O2↑ | |
| D. | 每产生标准状况下2.24L氢气,就有0.1mol阳离子通过交换膜进入阴极区 |
15.下列有关离子检验的操作和实验结论正确的是( )
| A. | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加稀硝酸,沉淀不溶解 该溶液中一定含有SO42- | |
| B. | 向某溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀生成 该溶液中一定含有SO42- | |
| C. | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 该溶液一定含有CO32- | |
| D. | 向某溶液中加入NaOH浓溶液并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体 该溶液中一定含有NH4+ |
5.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13.X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍.下列说法正确的是( )
| A. | X的氢化物溶于水显酸性 | |
| B. | Y的氧化物是离子化合物 | |
| C. | Z的氢化物的水溶液在空气中存放不易变质 | |
| D. | X和Z的最高价氧化物对应的水化物可发生中和反应 |
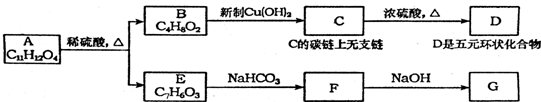
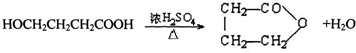 ,反应类型是酯化反应或取代反应.
,反应类型是酯化反应或取代反应.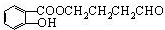 ,E的结构简式是
,E的结构简式是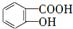 .
. 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空: