题目内容
1.把下列现象中硫酸所表现出来的性质填写在空白处.(1)盛有浓硫酸的烧杯敞口放置一段时间后,质量增加.吸水性
(2)用玻璃棒蘸浓硫酸滴在纸上时,纸变黑.脱水性
(3)把木炭放入热的浓硫酸中时,有气体放出.强氧化性.
分析 (1)浓硫酸具有吸水性,能吸收水分而作干燥剂;
(2)浓硫酸能将有机物中的H、O元素以水分子形式脱去;
(3)浓硫酸和碳反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,根据元素化合价变化确定.
解答 解:(1)浓硫酸具有吸水性,能吸收空气中的水蒸气,所以盛有浓硫酸的烧杯敞口放置一段时间后因为吸收空气中的水蒸气而导致质量增加,故答案为:吸水性;
(2)浓硫酸将纸张中的H、O元素以2:1水分子的形式脱去,体现脱水性,故答案为:脱水性;
(3)浓硫酸和碳反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,C元素化合价由0价变为+4价、S元素化合价由+6价变为+4价,该反应中浓硫酸体现强氧化性,故答案为:强氧化性.
点评 本题考查了浓硫酸的性质,浓硫酸具有酸性、吸水性、脱水性、强氧化性等性质,根据物质的性质来分析解答,注意吸水性和脱水性的区别,知道钝化现象原理,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.被称为万能还原剂的NaBH4溶于水并和水反应如下,下列说法中正确的是(NaBH4中B元素为+3价)NaBH4+2H2O=NaBO2+4H2↑( )
| A. | NaBH4既是氧化剂也是还原剂 | |
| B. | NaBH4是还原剂,H2O是氧化剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | 被氧化的元素与被还原的元素质量比为1:1 |
13.如图装置所示,以二甲醚为燃料形成的燃料电池,下列有关说法正确的是( )
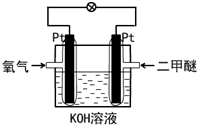

| A. | 电流流向:右边Pt电极→导线→左边Pt电极 | |
| B. | 通入氧气这边的Pt电极为负极 | |
| C. | 溶液中OH-向右边Pt电极移动 | |
| D. | 通入二甲醚的电极反应式:12OH-+CH3OCH3-12e-=2CO2+9H2O |
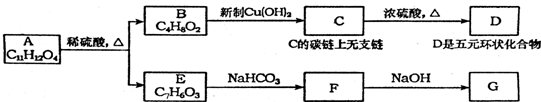
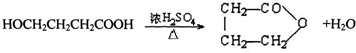 ,反应类型是酯化反应或取代反应.
,反应类型是酯化反应或取代反应.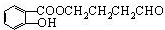 ,E的结构简式是
,E的结构简式是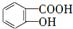 .
. 核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空:
核外电子数相等的微观粒子不一定是同种微粒,今有几种微粒的核外电子层结构如图所示,请按要求填空: ,它是极性(填“极性”或“非极性”)键形成的非极性分子.
,它是极性(填“极性”或“非极性”)键形成的非极性分子.