题目内容
11.工业合成氨与制备硝酸一般可连续生产,回答下列问题:(1)工业生产时,制取氢气的一个反应为:CO+H2O(g)?CO2+H2.T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果).
(2)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1.
(3)氨气在纯氧中燃烧,生成一种单质和水.科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极在碱性条件下发生反应的电极反应式为2NH3-6e-+6OH-=6H2O+N2.
分析 (1)1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.则
CO+H2O(g)?CO2+H2
开始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算K;
(2)由①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,
结合盖斯定律可知,$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g);
(3)通入氨气的电极在碱性条件下,失去电子生成氮气和水.
解答 解:(1)1L密闭容器中充入0.2mol CO和0.3mol水蒸气.反应建立平衡后,体系中c(H2)=0.12mol•L-1.则
CO+H2O(g)?CO2+H2
开始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
K=$\frac{0.12×0.12}{0.08×0.18}$=1,
故答案为:1;
(2)由①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1,
结合盖斯定律可知,$\frac{①+②}{2}$得到CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g),△H=(-574kJ•mol-1+-1160kJ•mol-1)×$\frac{1}{2}$=-867kJ•mol-1,
即热化学方程式为CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1,
故答案为:CH4(g)+2NO2(g)=CO2(g)+2H2O(g)+N2(g)△H=-867kJ•mol-1;
(3)通入氨气的电极在碱性条件下,失去电子生成氮气和水,电极反应为2NH3-6e-+6OH-=6H2O+N2,故答案为:2NH3-6e-+6OH-=6H2O+N2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算、盖斯定律应用、电极反应为解答的关键,侧重分析与应用能力的考查,注意化学反应原理的综合应用,综合性较强,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,倒置,观察是否漏水 | |
| C. | 在分液漏斗中分离两种液体时,要先从下端放出密度较大的液体,关闭活塞,取另一只烧杯后打开活塞再放出密度较小的液体 | |
| D. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| A. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| B. | 固体KC1不导电,但KC1是电解质 | |
| C. | 氯水能导电,所以Cl2是电解质 | |
| D. | CO2的水溶液能导电,所以CO2是电解质 |
| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
| A. | 凭气味和颜色 | |
| B. | 通入AgNO3溶液 | |
| C. | 干燥的蓝色石蕊试纸,观察其颜色变化 | |
| D. | 紫色石蕊试液 |
| A. | 某无色溶液滴入紫色石蕊试液显红色,该溶液一定显碱性 | |
| B. | 某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐 | |
| C. | 验证烧碱溶液中是否含有Cl-,先加稀硝酸除去OH-,再加入AgNO3溶液,有白色沉淀,证明含Cl- | |
| D. | 某溶液中先滴加少量BaCl2溶液,再滴加足量稀盐酸,生成白色沉淀,证明该溶液一定含有SO42- |
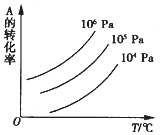 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )| A. | △H<0;△S<0 | B. | △H>0;△S>0 | C. | △H<0;△S>0 | D. | △H>0;△S<0 |

 CO↑+H2O.
CO↑+H2O.