题目内容
1.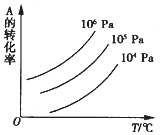 有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )
有一化学平衡mA(g)+nB(g)?pC(g)+qD(g),如图表示的是A的转化率与压强、温度的关系.下列正确的是( )| A. | △H<0;△S<0 | B. | △H>0;△S>0 | C. | △H<0;△S>0 | D. | △H>0;△S<0 |
分析 由图可知,在一条等压线上,温度越高,A的转化率越大,则升高温度、平衡正向移动;
向横坐标作垂线可知,相同温度下,压强越大,A的转化率越大,则增大压强,平衡正向移动,以此来解答.
解答 解:由图可知,在一条等压线上,温度越高,A的转化率越大,则升高温度、平衡正向移动,可知正反应为吸热反应,即△H>0;
向横坐标作垂线可知,相同温度下,压强越大,A的转化率越大,则增大压强,平衡正向移动,可知该反应为气体体积减小的反应,m+n>p+q,即△S<0,
故选D.
点评 本题考查化学平衡移动,为高频考点,把握图象分析、平衡移动为解答的关键,侧重分析与应用能力的考查,注意温度、压强对平衡移动的影响,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
12.下列离子方程式书写正确的是( )
| A. | CuSO4溶液与Ba (OH)2溶液反应:Ba2++SO42-═BaSO4↓ | |
| B. | NaHSO4溶液和NaHCO3溶液反应:H++HCO3-═H2O+CO2↑ | |
| C. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 往BaCl2溶液中通入少量的SO2:Ba2++SO2+H2O═BaSO3↓+2H+ |
11.已知溶液中存在平衡:Ca(OH)2(s)?Ca2+(aq)+2OH-(aq)△H<0.下列有关该平衡体系的叙述正确的是( )
| A. | 升高温度,固体的量减少 | |
| B. | 加入少量Na2CO3粉末能增大钙离子的浓度 | |
| C. | 降低温度,溶液中c(OH-)增大 | |
| D. | 恒温下加入少量CaO,溶液的pH增大 |
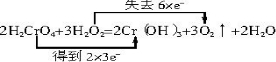 .
. 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.