题目内容
9.某温度下,将2molA和3molB充入体积为2L的密闭容器中进行化学反应:A(g)+B(g)?2C(g)△H<0,反应进行到10s时达到平衡,此时测得C的物质的量为2.4mol.回答下列问题:(1)反应达平衡时B在平衡混合气体中的体积分数为36%;
(2)若反应温度升高,A的转化率减小;(填“增大”、“减小”或“不变”)
(3)该温度下该反应的平衡常数K=4;
(4)平衡后,其他条件不变的情况下,将体积压缩到原来的$\frac{1}{2}$时,对该反应产生的影响是CD;
A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动
B.正、逆反应速率都不变,平衡不移动,各物质物质的量不变
C.正、逆反应速率都增大,平衡不移动,B的物质的量浓度为1.8mol/L
D.正、逆反应速率都增大,平衡不移动,各物质的物质的量不变
(5)可以证明恒温恒容条件下该可逆反应已达到平衡状态的是C.
A.混合气体的密度不随时间而改变
B.混合气体的平均摩尔质量不随时间而改变
C.B和C在混合气体中的体积分数之比不随时间而改变
D.体系的压强不随时间而改变
(6)若维持容器体积和温度不变,某时刻测得A、B、C的浓度分别为1mol/L、3mol/L、2mol/L,则此时该反应的正反应速率大于逆反应速率.(填“大于”、“小于”或“等于”)
分析 (1)某温度下,A(g)+B(g)?2C(g)△H<0
开始(mol) 2 3 0
反应(mol) 1.2 1.2 2.4
平衡(mol) 0.8 1.8 2.4
相同条件下气体的体积分数等于其物质的量分数=$\frac{平衡时n(B)}{平衡时总物质的量}$×100%;
(2)升高温度平衡向吸热方向移动;
(3)开始时c(A)=$\frac{2mol}{2L}$=1mol/L、c(B)=$\frac{3mol}{2L}$=1.5mol/L,平衡时c(C)=$\frac{2.4mol}{2L}$=1.2mol/L,
某温度下,A(g)+B(g)?2C(g)△H<0
开始浓度(mol/L) 1 1.5 0
反应浓度(mol/L)0.6 0.6 1.2
平衡浓度(mol/L)0.4 0.9 1.2
化学平衡常数K=$\frac{{c}^{2}(C)}{c(A).c(B)}$;
(4)平衡后,其他条件不变的情况下,将体积压缩到原来的$\frac{1}{2}$时,压强增大平衡不移动,但各物质的浓度增大为原来的2倍;
(5)可逆反应达到平衡状态时,正逆反应速率相等且反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(6)先计算浓度商,根据浓度商与化学平衡常数相对大小确定反应方向,从而确定正逆反应速率相对大小.
解答 解:(1)某温度下,A(g)+B(g)?2C(g)△H<0
开始(mol) 2 3 0
反应(mol) 1.2 1.2 2.4
平衡(mol) 0.8 1.8 2.4
相同条件下气体的体积分数等于其物质的量分数=$\frac{平衡时n(B)}{平衡时总物质的量}$×100%=$\frac{1.8mol}{(0.8+1.8+2.4)mol}$×100%=36%,
故答案为:36%;
(2)该反应的正反应是放热反应,升高温度平衡向吸热方向即逆反应方向移动,A的转化率减小,
故答案为:减小;
(3)开始时c(A)=$\frac{2mol}{2L}$=1mol/L、c(B)=$\frac{3mol}{2L}$=1.5mol/L,平衡时c(C)=$\frac{2.4mol}{2L}$=1.2mol/L,
某温度下,A(g)+B(g)?2C(g)△H<0
开始浓度(mol/L) 1 1.5 0
反应浓度(mol/L)0.6 0.6 1.2
平衡浓度(mol/L)0.4 0.9 1.2
化学平衡常数K=$\frac{{c}^{2}(C)}{c(A).c(B)}$=$\frac{1.2×1.2}{0.4×0.9}$=4,
故答案为:4;
(4)平衡后,其他条件不变的情况下,将体积压缩到原来的$\frac{1}{2}$时,压强增大平衡不移动,但各物质的浓度增大为原来的2倍,所以B物质浓度是1.8mol/L,但各物质的物质的量不变,故选CD;
(5)A.无论反应是否达到平衡状态,混合气体的密度始终不变,所以不能据此判断平衡状态,故A错误;
B.反应前后气体的物质的量不变、气体的质量不变,所以混合气体的平均摩尔质量始终不变,不能据此判断平衡状态,故B错误;
C.B和C在混合气体中的体积分数之比不随时间而改变时,正逆反应速率相等,反应达到平衡状态,故C正确;
D.反应前后气体总物质的量不变,则体系的压强始终不变,不能据此判断平衡状态,故D错误;
故选C;
(6)该反应的浓度商=$\frac{2×2}{1×3}$=1.3<4,平衡正向移动,则正反应速率大于逆反应速率,
故答案为:大于.
点评 本题考查化学平衡原理有关知识,涉及化学平衡计算、化学平衡状态判断、外界条件对化学平衡影响等知识点,侧重考查学生对基本概念的理解、掌握和运用,会根据浓度商与化学平衡常数关系确定反应方向,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 5.04g | B. | 3.6g | C. | 6.48g | D. | 3.24g |
| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) mol | 0.200 | c1 | 0.10 | c3 | a | b |
| n(NO2) mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
(1)该反应的化学方程式为N2O4(g)?2 NO2(g),
(2)达到平衡时四氧化二氮的转化率为60%.
(3)20s时四氧化二氮的浓度c1=0.07 mol•L-1,
(4)在0~20s时间段内,二氧化氮的平均反应速率为0.003mol/(L.s).
| A. | 在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3- |


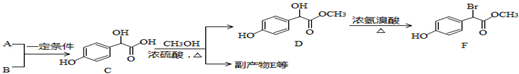
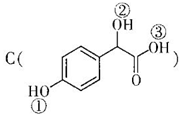 中①、②、③3个-OH的酸性有强到弱的顺
中①、②、③3个-OH的酸性有强到弱的顺 
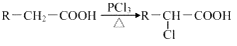

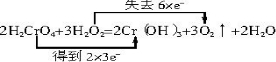 .
.