题目内容
6.某同学查阅资料后设计了一条1-丁醇的合成路线:CH3CH=CH2+CO+H2$\stackrel{一定条件}{→}$CH3CH2CH2CHO$→_{Ni△}^{H_{2}}$CH3CH2CH2CH2OH

(1)利用图一装置可制备CO、丙烯等原料气体.①装置中e的名称是分液漏斗;②a的作用平衡内外压强,保证液体顺畅流下;
(2)实验室常用浓硫酸与甲酸作用来制备CO.写出对应的化学方程式:HCOOH
 CO↑+H2O.
CO↑+H2O.(3)制CO时,伴随的副产物还有少量S02、C02气体,某同学设计用图二装置进行检验.
①E1的作用是:检验产物是否有S02;E3的作用是:检验S02是否除尽;
②判断产物中有CO2的现象是E3中品红不褪色,F中石灰水变浑浊
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是D;
A.高温、常压、催化剂 B.适当的温度、常压、催化剂
C.低温、高压、催化剂 D.适当的温度、高压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1一丁醇粗品,为提纯1-丁醇,该小组查阅文献得知:①R-CHO+NaHS03(饱和)→RCH(OH)S03Na↓;②沸点:乙醚34℃,1-丁醇118℃.并设计出如下提纯路线:

试剂1为饱和NaHS03溶液,操作2为萃取,操作3为蒸馏.
分析 CO的制备方法:HCOOH CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
(1)①根据装置图中e的构造可知e为分液漏斗;
②为了使产生的气体能顺利的从发生装置中排出,就必需保持压强一致,因此a的作用是保持恒压;
(2)甲酸在浓硫酸作用下脱水生成CO,根据元素守恒和元素守恒可书写化学方程式;
(3)要检验CO中少量S02、C02气体,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,再用品红检验是否除尽,用石灰水检验二氧化碳,所以E1中装置品红溶液,E2中装置酸性高锰酸钾溶液,E3中装品红溶液,F中装澄清石灰水;
(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率;
(5)根据题中物质提纯的流程,粗品中含有正丁醛,利用信息①可知饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;加入乙醚的目的是萃取溶液中的1-丁醇,1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开
解答 解:CO的制备方法:HCOOH CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
CO↑+H2O,在题给装置中,导管a平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,还需用浓硫酸除去CO中的H2O,
(1)①根据仪器e的构造可知e为分液漏斗,故答案为:分液漏斗;
②CO的制备方法为:HCOOH CO↑+H2O,反应中有气体产生,为了平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,所以使用了导管a,
CO↑+H2O,反应中有气体产生,为了平衡分液漏斗内压强,使分液漏斗内的液体浓硫酸顺利滴下,所以使用了导管a,
故答案为:平衡内外压强,保证液体顺畅流下;
(2)甲酸在浓硫酸作用下脱水生成CO气体和水,反应的化学方程式为:HCOOH CO↑+H2O,
CO↑+H2O,
故答案为:HCOOH CO↑+H2O;
CO↑+H2O;
(3)要检验CO中少量S02、C02气体,用品红检验二氧化硫,并用酸性高锰酸钾除去二氧化硫,再用品红检验是否除尽,用石灰水检验二氧化碳,所以E1中装置品红溶液,E2中装置酸性高锰酸钾溶液,E3中装品红溶液,F中装澄清石灰水,
①根据上面的分析可知,E1的作用是:检验产物是否有S02,E3的作用是检验S02是否除尽,
故答案为:检验产物是否有S02;检验S02是否除尽;
②判断产物中有CO2的现象是E3中品红不褪色,F中石灰水变浑浊,
故答案为:E3中品红不褪色,F中石灰水变浑浊;
(4)由于反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率;正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度;催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短到达平衡所需要的时间,故正确所选项是D,
故答案为:D;
(5)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇;因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,
故答案为:饱和NaHSO3溶液;萃取;蒸馏.
点评 本题考查制备方案的设计,题目难度中等,涉及气体的制备、有机物的分离、提纯方法、醇的性质以及对基础知识和基本操作的考查,答题时注意把握基础知识和基本实验操作的灵活运用,试题培养了学生的分析、理解能力及化学实验能力.


| A. | 铝粉与氧化铁在加热条件下的反应 | |
| B. | 灼热的碳与二氧化碳反应 | |
| C. | Ba(OH)2•8H2O晶体和NH4Cl晶体混合 | |
| D. | 碳与水高温条件下制取水煤气的反应 |
| A. | 在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42- | |
| B. | 在含有大量H+的溶液中:Na+、K+、CO32-、NO3- | |
| C. | 在强酸的溶液中:NH4+、Na+、SO42-、Cl- | |
| D. | 在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3- |
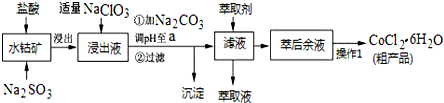
已知:
①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
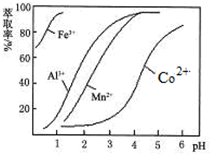
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5.
 如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )
如图表示在密闭容器中反应C(s)+H2O(g)$\stackrel{高温}{?}$CO(g)+H2(g);△H>0,达到平衡后,由于条件的改变而引起正、逆反应速率的变化,以及平衡移动的状况.据图可知,改变的条件是( )| A. | 增加CO浓度 | B. | 升高温度 | C. | 增加水蒸气 | D. | 增大压强 |
| A. | 食盐水、糖水、冰水都属于混合物 | |
| B. | 烧碱、火碱、消石灰都属于碱 | |
| C. | KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸 | |
| D. | 溶液、胶体、浊液都属于稳定的分散系 |