题目内容
16.配制2mol/L的NaCl溶液950mL时应选用的容量瓶的规格和NaCl质量分别是( )| A. | 950mL 111.2g | B. | 1000mL 117g | C. | 1000mL 111.2g | D. | 950mL 117g |
分析 依据配制溶液的体积和实验室常用容量瓶规格选项合适的容量瓶,依据m=CVM计算需要溶质的质量解答.
解答 解:配制2mol/L的NaCl溶液950mL,实验室没有950mL容量瓶,应选择1000mL容量瓶,实际配制1000mL溶液,需要溶质的质量m=2mol/L×1L×58.5g/mol=117g;
故选:B.
点评 本题考查了一定物质的量浓度溶液的配制,侧重考查仪器的选择和有关物质的量计算,明确以物质的量为核心的计算公式,熟悉常见容量瓶规格及选择依据是解题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
17.在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:
(1)该反应的化学方程式为N2O4(g)?2 NO2(g),
(2)达到平衡时四氧化二氮的转化率为60%.
(3)20s时四氧化二氮的浓度c1=0.07 mol•L-1,
(4)在0~20s时间段内,二氧化氮的平均反应速率为0.003mol/(L.s).
| 时间(S) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) mol | 0.200 | c1 | 0.10 | c3 | a | b |
| n(NO2) mol | 0.000 | 0.120 | c2 | 0.240 | 0.240 | 0.240 |
(1)该反应的化学方程式为N2O4(g)?2 NO2(g),
(2)达到平衡时四氧化二氮的转化率为60%.
(3)20s时四氧化二氮的浓度c1=0.07 mol•L-1,
(4)在0~20s时间段内,二氧化氮的平均反应速率为0.003mol/(L.s).



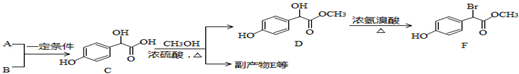
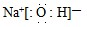 ;
;
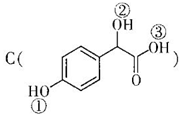 中①、②、③3个-OH的酸性有强到弱的顺
中①、②、③3个-OH的酸性有强到弱的顺 
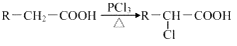

 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O学习小组的同学设计了滴定的方法测定x值.