题目内容
3.若以乙醇燃料电池为电源,KOH为电解质溶液.用石墨作电极电解100mL含有如表离子的溶液.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
分析 ①燃料电池的负极上是燃料失电子的氧化反应,根据电解质环境书写电极反应式;
②电解原理:阴极上显示铜离子得电子,然后是氢离子得电子产生氢气,在阳极上是氯离子失电子的反应,产生氯气,然后是氢氧根离子失电子产生氧气,一段时间后,当两极收集到相同体积(相同条件)的气体时,根据电子守恒计算阳极上收集到氧气的物质的量.
解答 解:①燃料电池中,失去电子的为负极,在碱性条件下,乙醇失去电子生成碳酸根离子和水,电解反应式为:CH3CH2OH-12e-+16OH-=2CO32-+11H2O,故答案为:CH3CH2OH-12e-+16OH-=2CO32-+11H2O;
②阴极上显示铜离子得电子,Cu2++2e-=Cu,100mL1mol/L的铜离子得电子物质的量是0.2mol,然后是2H++2e-=H2↑,在阳极上是0.4mol氯离子失电子的反应,产生氯气0.2mol,2Cl--2e-=Cl2↑,转移电子是0.4mol,然后是氢氧根离子失电子产生氧气,4OH--4e-=O2↑+2H2O,当两极收集到相同体积(相同条件)的气体时,假设产生氧气的物质的量是x,在阳极上产生气体是(0.2+x)mol,根据电子守恒,得到0.4+4x=0.2+2(0.2+x),解得x=0.1mol,即阳极上收集到氧气的物质的量为0.1mol.
故答案为:0.1.
点评 本题考查电化学知识、原电池、电解池工作原理,题目难度中等,做题时注意电极的判断和电极反应的书写,注意串联电路中各电极转移的电子数目相等,利用反应的方程式计算即可.

练习册系列答案
相关题目
16. 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中,与水充分作用后,试管内水面上升,但不能充满试管,当向试管内鼓如氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体可能是( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中,与水充分作用后,试管内水面上升,但不能充满试管,当向试管内鼓如氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体可能是( )
 如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中,与水充分作用后,试管内水面上升,但不能充满试管,当向试管内鼓如氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体可能是( )
如图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中,与水充分作用后,试管内水面上升,但不能充满试管,当向试管内鼓如氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,原来试管中盛装的气体可能是( )| A. | N2与NO2的混和气体 | B. | NO2与O2按4:1体积比混合的气体 | ||
| C. | NO与NO2的混和气体 | D. | NO与O2按4:3体积比混合的气体 |
11.下列有关电解的说法正确的有( )
| A. | 在铁件上镀银时,金属银作电解槽的阴极 | |
| B. | 用石墨电极电解硫酸溶液,其实质是电解水,故溶液PH值不变 | |
| C. | 电解法精炼铜时,电解一段时间后,电解液中C(Cu2+)将略有下降 | |
| D. | 为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的正极相连 |
18.500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(K+)为4mol/L | |
| B. | 原溶液中c(Cu2+)为1mol/L | |
| C. | 电解后溶液中c(H+)为8mol/L | |
| D. | 电解后加入1molCu(OH)2可使溶液复原 |
14.有温度和容积均相同的两容器Ⅰ、Ⅱ,向Ⅰ中加入1mol NO2,Ⅱ中加入2mol NO2,都将发生反应2NO2(g)?N2O4(g),反应达到平衡时,测得Ⅰ中NO2的转化率为a%,Ⅱ中NO2的转化率为b%,则a、b的关系为( )
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
11.下列关于各实验装置的叙述中,正确的是( )
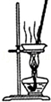 | 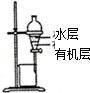 |
| A.装置可用于蒸干氯化铝溶液制AlCl3 | B.装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
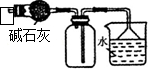 | 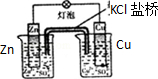 |
| C.装置可用于收集NH3或HCl气体,并防止倒吸 | D.装置盐桥中的K+自右向左移动 |
| A. | A | B. | B | C. | C | D. | D |
12.用惰性电极进行电解,下列说法正确的是( )
| A. | 电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 | |
| D. | 电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4:1 |
 HCO3-+H+
HCO3-+H+