题目内容
11.下列关于各实验装置的叙述中,正确的是( ) 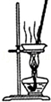 | 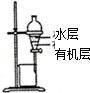 |
| A.装置可用于蒸干氯化铝溶液制AlCl3 | B.装置可用于分离CCl4萃取碘水后已分层的有机层和水层 |
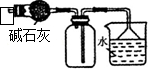 | 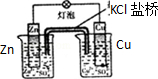 |
| C.装置可用于收集NH3或HCl气体,并防止倒吸 | D.装置盐桥中的K+自右向左移动 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加热时应防止氯化铝水解;
B.四氯化碳不溶于水,且密度比水大;
C.HCl不能用碱石灰干燥;
D.原电池工作时,阳离子向正极移动.
解答 解:A.氯化铝水解生成氢氧化铝,加热时应防止氯化铝水解,否则不能得到氯化铝,故A错误;
B.四氯化碳不溶于水,且密度比水大,可用于分液的方法分离,四氯化碳在下层,故B正确;
C.HCl不能用碱石灰干燥,故C错误;
D.锌比铜活泼,为原电池负极,铜为正极,原电池工作时,阳离子向正极移动,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及盐类的水解、原电池、气体额干燥以及分液等,把握实验原理及实验装置图的作用为解答的关键,注意方案的合理性、操作性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.若以乙醇燃料电池为电源,KOH为电解质溶液.用石墨作电极电解100mL含有如表离子的溶液.
①电池工作时负极反应式为CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
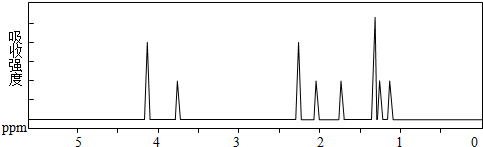
6.某化合物的结构式(键线式)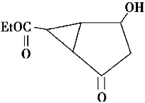 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
3.下列叙述正确的是( )
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
20.某实验小组依据反应AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图.下列有关叙述错误的是( )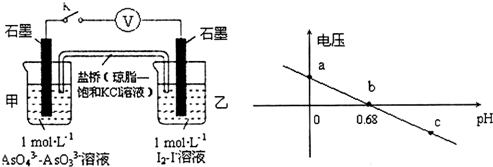

| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
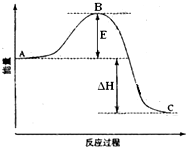 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: