题目内容
11.下列有关电解的说法正确的有( )| A. | 在铁件上镀银时,金属银作电解槽的阴极 | |
| B. | 用石墨电极电解硫酸溶液,其实质是电解水,故溶液PH值不变 | |
| C. | 电解法精炼铜时,电解一段时间后,电解液中C(Cu2+)将略有下降 | |
| D. | 为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的正极相连 |
分析 A.电镀池本质是电解池,但电镀池中,镀层金属作阳极,镀件作阴极,电镀液含有镀层金属阳离子;
B.根据离子放电顺序可知,实质是电解水,硫酸物质的量不变,但溶液体积减小;
C.阳极上,粗铜中比Cu活泼的金属首先放电,然后Cu再放电形成Cu2+进入溶液,而阴极上是铜离子放电析出Cu;
D.构成电解池进行金属防护时,被保护的金属应作阴极.
解答 解:A.在铁件上镀银时,金属银作电解槽的阳极,铁件作阴极,故A错误;
B.根据离子放电顺序可知,用石墨电极电解硫酸溶液,实质是电解水,硫酸物质的量不变,但溶液体积减小,溶液酸性增强,则溶液pH减小,故B错误;
C.阳极上,粗铜中比Cu活泼的金属首先放电,然后Cu再放电形成Cu2+进入溶液,而阴极上是铜离子放电析出Cu,由电子转移守恒可知,阴极析出的Cu比阳极消耗的Cu多,则电解液中C(Cu2+)将略有下降,故C正确;
D.为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的负极相连,为外加电流的阴极保护法,故D错误,
故选:C.
点评 本题考查电解工作原理及其应用,涉及电镀、粗铜精炼、金属腐蚀与防护,关键理解电解池工作原理,注意电镀池中镀层金属作阳极,镀件作阴极,电镀液含有镀层金属阳离子.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
4.下列热化学方程式中的△H可表示燃烧热的是( )
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8KJ/mol | |
| B. | C2H4(g)+O2(g)═2CO2(g)+2H2O(l)△H=-1411.0KJ/mol | |
| C. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-6071.3KJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ/mol |
1.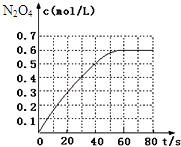 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
16.向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是( )
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
3.若以乙醇燃料电池为电源,KOH为电解质溶液.用石墨作电极电解100mL含有如表离子的溶液.
①电池工作时负极反应式为CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
20.某实验小组依据反应AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图.下列有关叙述错误的是( )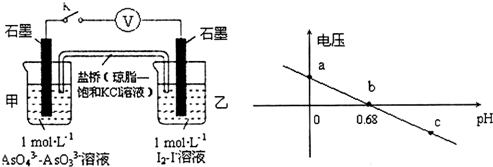

| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
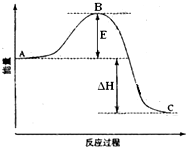 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: