题目内容
14.有温度和容积均相同的两容器Ⅰ、Ⅱ,向Ⅰ中加入1mol NO2,Ⅱ中加入2mol NO2,都将发生反应2NO2(g)?N2O4(g),反应达到平衡时,测得Ⅰ中NO2的转化率为a%,Ⅱ中NO2的转化率为b%,则a、b的关系为( )| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
分析 在温度和容积均相同的两容器,Ⅱ相当于两个Ⅰ达平衡时压缩到一个容器中,即增大压强,平衡正向移动,由此分析解答.
解答 解:在温度和容积均相同的两容器,Ⅱ相当于两个Ⅰ达平衡时压缩到一个容器中,即增大压强,平衡正向移动,所以Ⅱ中NO2的转化率大于Ⅰ中NO2的转化率,即a<b,故选A.
点评 本题考查化学平衡的影响因素,难度中等,注意构建平衡建立的途径是解题的关键,注意理解压强对化学平衡的影响本质.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
3.若以乙醇燃料电池为电源,KOH为电解质溶液.用石墨作电极电解100mL含有如表离子的溶液.
①电池工作时负极反应式为CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
9.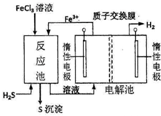 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
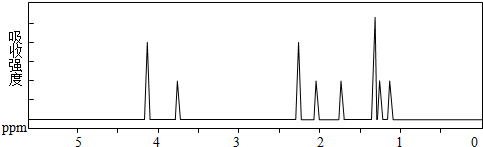
6.某化合物的结构式(键线式)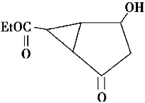 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
 及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
及其核磁共振氢谱图如下:下列关于该有机物的叙述正确的是( )
| A. | 该有机物不同化学环境的氢原子有6种 | |
| B. | 该有机物属于芳香族化合物 | |
| C. | 键线式中的Et代表的基团为-CH3 | |
| D. | 该有机物的分子式为C9H12O4 |
3.下列叙述正确的是( )
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
4.取m g AgNO3固体粉末充分加热,得到b g Ag和a L NO2与O2的混合气体,将气体用足量水吸收,剩余气体的体积为c L,下列结论一定正确的是( )
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |
 A↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是
A↑+2B↑+4C↑,测得反应后生成的混合气体对H2的相对密度为11.43,在相同条件下,X的相对分子质量是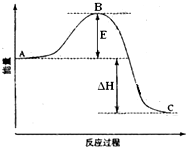 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: