题目内容
12.用惰性电极进行电解,下列说法正确的是( )| A. | 电解稀硫酸溶液,实质上是电解水,故溶液中c(H+)不变 | |
| B. | 电解稀氢氧化钠溶液,要消耗OH-,故溶液中c(OH-)减小 | |
| C. | 电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2 | |
| D. | 电解硝酸银溶液,在阴极上和阳极上析出的产物的物质的量之比可能不为4:1 |
分析 A.根据离子放电顺序可知,实质是电解水,溶液体积减小;
B.电解稀氢氧化钠溶液,实质上是电解水,NaOH物质的量不变,而溶液体积减小;
C.电解硫酸钠溶液,实质是电解水,电池总反应式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阴极析出氢气,阳极析出氧气;
D.电解硝酸银溶液,阳极电极反应式:4OH--4e-=2H2O+O2↑,阴极首先发生反应:4Ag++4e-=4Ag,Ag+放电完毕,会发生反应:4H++4e-=2H2↑,结合电子转移守恒判断.
解答 解:A.根据离子放电顺序可知,电解稀硫酸溶液实质是电解水,溶液体积减小,硫酸的物质的量不变,则溶液中c(H+)增大,故A错误;
B.电解稀氢氧化钠溶液,实质上是电解水,NaOH物质的量不变,而溶液体积减小,则溶液中c(OH-)增大,故B错误;
C.电解硫酸钠溶液,实质是电解水,电池总反应式为:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,阴极析出氢气,阳极析出氧气,在阴极上和阳极上析出的产物的物质的量之比为2:1,故C错误;
D.电解硝酸银溶液,阳极电极反应式:4OH--4e-=2H2O+O2↑,阴极首先发生反应:4Ag++4e-=4Ag,Ag+放电完毕,会发生反应:4H++4e-=2H2↑,当阴极有H+放电时,在阴极上和阳极上析出的产物的物质的量之比不是4:1,故D正确,
故选:D.
点评 本题考查电解原理,关键是理解掌握了电解时溶液中离子的放电顺序,理解掌握电解类型:①电解水型、②电解电解质型、③放氧生酸型、④放氢生碱型.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.若以乙醇燃料电池为电源,KOH为电解质溶液.用石墨作电极电解100mL含有如表离子的溶液.
①电池工作时负极反应式为CH3CH2OH-12e-+16OH-=2CO32-+11H2O.
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
②电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气的物质的量为0.1mol.
3.下列叙述正确的是( )
| A. | 标准状况下,22.4LCl2完全反应转移电子数一定为2×6.02×1023 | |
| B. | 因SO2具有漂白性,故可使品红溶液、酸性KMnO4溶液褪色 | |
| C. | 常温下,$\frac{c(OH-)}{c(H+)}$=10-10的溶液中:Na+、Al3+、SO42-、NO3-可大量共存 | |
| D. | 将20.0gNaOH固体置入500mL容量瓶,然后加水至刻度线即得1.00mol/L的NaOH溶液 |
20.某实验小组依据反应AsO43-+2H++2I-?AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图.下列有关叙述错误的是( )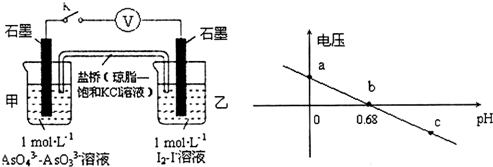

| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
4.取m g AgNO3固体粉末充分加热,得到b g Ag和a L NO2与O2的混合气体,将气体用足量水吸收,剩余气体的体积为c L,下列结论一定正确的是( )
| A. | 混合气体中NO与O2的体积之比为4:1 | |
| B. | 水吸收后的剩余气体是O2,且c=$\frac{a}{6}$ | |
| C. | 取m g AgNO3溶于水再加足量盐酸可生成沉淀$\frac{2a}{3×22.4}$×143.5g | |
| D. | 水吸收后所得溶液中HNO3的物质的量浓度为$\frac{b}{108}$mol•L-1 |